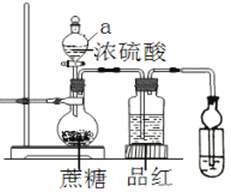
题目内容
【题目】取钠-镁合金7.0克进行如下实验:

(1)写出Mg在CO2中燃烧的化学方程式
(2)向溶液1中加过量的NaOH溶液,发生反应的离子方程式为
(3)写出合金的化学组成
【答案】(1) 2Mg+CO2=2MgO+C;
(2)H++OH-=H2O Mg2++2OH- =Mg(OH)2;(3)Na2Mg
【解析】
试题分析:(1)Mg在CO2中燃烧生成碳和氧化镁,反应的化学方程式为:2Mg+CO2=2MgO+C,答案为:2Mg+CO2=2MgO+C;(2)钠-镁合金中加入过量的盐酸,得到的溶液1中的溶质有氯化钠、氯化镁、氯化氢,再向溶液1中加过量的NaOH溶液,发生反应的离子方程式为:H++OH-=H2O Mg2++2OH- =Mg(OH)2 ,答案为:H++OH-=H2O Mg2++2OH- =Mg(OH)2 ;(3)设合金中钠的物质的量为x,镁的物质的量为y,则有23x+24y=7.0g,(x/2+y)×22.4L/mol=4.48L,算出x=0.21mol,y=0.1mol,合金的化学式为:Na2Mg,答案为:Na2Mg.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目