题目内容
17.下列反应中,反应物用量或浓度改变时,不会改变生成物的是( )| A. | 铜和硝酸反应 | B. | H2S与氧气反应 | ||
| C. | 碳酸钠溶液和盐酸反应 | D. | 硫在氧气中燃烧 |
分析 A.浓硝酸、稀硝酸和Cu反应产物不同;
B.H2S部分氧化生成S,完全氧化生成二氧化硫;
C.碳酸钠溶液和盐酸反应,量不同产物不同;
D.硫在氧气中燃烧生成二氧化硫气体.
解答 解:A.铜和稀硝酸反应,浓度改变产物不同,稀硝酸反应生成一氧化氮气体,浓硝酸反应生成二氧化氮气体,故A不选;
B.H2S与少量的氧气反应生成S,与过量的氧气完全氧化生成二氧化硫,反应物的量不同产物不同,故B不选;
C.碳酸钠溶液中滴入少量盐酸生成碳酸氢钠和氢氧化钠,碳酸钠滴入过量的盐酸生成二氧化碳气体,故C不选;
D.硫在氧气中燃烧生成二氧化硫,反应物的用量或浓度改变时,不会改变生成物,故D选;
故选D.
点评 本题考查物质之间反应,明确物质性质是解本题关键,部分反应中与反应物的量、反应物浓度、反应温度有关,注意总结归纳,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍,装置原理如图所示,其中固体薄膜只允许Li+通过.锂离子电池反应为xLi+Li1-xMn2O4$?_{充电}^{放电}$LiMn2O4.

下列有关说法错误的是( )

下列有关说法错误的是( )
| A. | 该电池的缺点是存在副反应:2Li+2H2O═2LiOH+H2↑ | |
| B. | 放电时,正极反应为Li1-xMn2O4+xLi++xe-═LiMn2O4 | |
| C. | 充电时,电极 b 为阳极,发生氧化反应 | |
| D. | 放电时,Li+穿过固体薄膜进入到水溶液电解质中 |
2.下列说法中不正确的是( )
| A. | 淀粉和纤维素的化学式都是(C6H10O5)n,但由于n不同,淀粉和纤维素并不互为同分异构体 | |
| B. | 鉴别某白色纺织品的成分是蚕丝还是“人造丝”,可用灼烧的方法 | |
| C. | 乙醇可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液直接氧化成乙酸 | |
| D. | 酯化反应是不可逆的,所以不需要催化剂 |
6.如图为原电池示意图,下列说法正确的是( )


| A. | 该装置能够将化学能转化成电能 | B. | 锌是负极,发生还原反应 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 铜是负极,发生氧化反应 |
7.4-溴甲基-1-环己烯的一种合成路线如图:

下列说法正确的是( )

下列说法正确的是( )
| A. | ①是加成反应,②是还原反应 | |
| B. | W存在顺反异构,另一种结构为 | |
| C. | X的官能团由烯键和酯基 | |
| D. | 按照系统命名法, 为乙烯基丙酸乙酯 为乙烯基丙酸乙酯 |


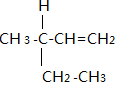
 .
.