题目内容
【题目】【化学选修3:物质结构与性质】
(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2 ,Q基态原子的外围电子(价电子)排布式为____________,
T2+的未成对电子数是______________;
(2)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
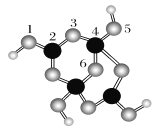
①在Xm-中,硼原子轨道的杂化类型有________;配位键存在于________原子之间(填子的数字标号);m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有______ (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储 氢后的化学式应为__________ 。
【答案】 3d64s2 2 sp2、sp3 4,5(或5,4) 2 ADE 3:1 金属键 H8AuCu3
【解析】(1)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T都属于第Ⅷ族元素,原子序数T比Q多2,可以确定Q为Fe元素, T为Ni元素;Fe元素是26号元素,Fe原子价态排布式为3d64s2; Ni2+的核外电子排布式为1s22s22p63s23d8,3d能级有2个单电子,即未成对电子数为2。
故答案为:3d64s2;2;
(2)①1,3,5,6代表氧原子;2,4代表B原子;2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化;B一般形成3个键,4号B形成4个键,其中1个键很可能就是配位键,配位键存在于4号与5号之间。②观察模型,可知Xm-是(H4B4O9) m-,依据化合价H为+1,B为+3,O为-2,可得m=2。
故答案为:sp2、sp3;4,5(或5,4);2;
②Na+与Xm-形成离子键,结晶水分子之间存在氢键和范德华力,故答案为:ADE;
(3)元素金(Au)处于周期表的第六周期,与Cu同族,则最外层电子数为1,价电子排布式为5d106s1;在晶胞中Cu原子处于面心,N(Cu)=6×![]() =3,Au原子处于顶点位置,N(Au) =8×
=3,Au原子处于顶点位置,N(Au) =8×![]() =1,则该合金中Cu原子与Au原子数量之比为3∶1。该晶体为金属晶体,原子间的作用力为金属键;CaF2的结构如图
=1,则该合金中Cu原子与Au原子数量之比为3∶1。该晶体为金属晶体,原子间的作用力为金属键;CaF2的结构如图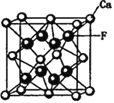 ,将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,Cu原子处于面心,所以晶胞中Cu原子个数为3,Au原子处于顶点位置,所以晶胞中由Au原子个数为1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,含8个H原子,所以化学式为H8AuCu3。
,将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,Cu原子处于面心,所以晶胞中Cu原子个数为3,Au原子处于顶点位置,所以晶胞中由Au原子个数为1,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,含8个H原子,所以化学式为H8AuCu3。
故答案为:3:1;金属键;H8AuCu3。

 名校课堂系列答案
名校课堂系列答案