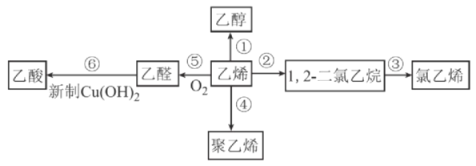
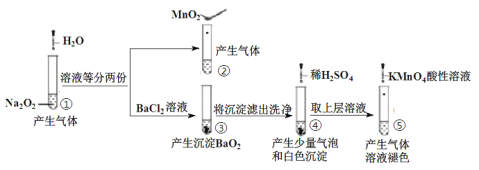
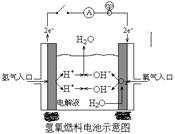
题目内容
【题目】向某恒容密闭容器中加入1.6 mol L-1的NO2后,会发生如下反应:2NO2(g)N2O4(g) △H =-56.9kJmol-1。其中N2O4的物质的量浓度随时间的变化如图所示,下列说法不正确的是

A.升高温度,60s后容器中混合气体颜色加深
B.0-60s内,NO2的转化率为75%
C.0-60s内,v(NO2)=0.02mol L-1 s-1
D.a、b两时刻生成NO2的速率v(a)>v(b)
【答案】D
【解析】
A. 放热反应,温度升高,平衡逆向移动,二氧化氮的量增加,颜色变深,A项正确;
B. 设容器体积为V,0-60s内,生成N2O4的物质的量为0.6Vmol,则消耗的NO2的物质的量为1.2Vmol,NO2的转化率为![]() =75%,B项正确;
=75%,B项正确;
C. 根据图中信息可知,从反应开始到刚达到平衡时间段内![]() =0.01 molL1s1,则v(NO2)=2 v(N2O4)=2×0.01 molL1s1=0.02molL1s1 ,C项正确;
=0.01 molL1s1,则v(NO2)=2 v(N2O4)=2×0.01 molL1s1=0.02molL1s1 ,C项正确;
D. 随着反应的进行,消耗的NO2的浓度越来越小,生成NO2的速率即逆反应速率越来越大,因此a、b两时刻生成NO2的速率:v(a)<v(b),D项错误;
答案选D。

练习册系列答案
相关题目
【题目】下列气体去除杂质的方法中,不能实现目的的是
气体(杂质) | 方法 | |
A | SO2(H2S) | 通过酸性高锰酸钾溶液 |
B | Cl2(HCl) | 通过饱和的食盐水 |
C | N2(O2) | 通过灼热的铜丝网 |
D | NO(NO2) | 通过氢氧化钠溶液 |
A.AB.BC.CD.D