题目内容
4.下列有关表述正确的是( )①元素所在的主族序数与最外层电子数之比为1的元素都是金属元素
②活泼金属与活泼非金属一定形成离子键
③同主族元素形成单质的熔沸点从上到下不一定都逐渐升高
④第三周期元素原子形成的简单离子半径从左到右依次减小.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③ |
分析 ①主族元素族序数=最外层电子数,主族元素包含金属元素与非金属元素;
②氯化铝属于共价化合物;
③卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低;
④微粒半径,电子层越多,半径越大,电子层一样,核电荷数越多,半径越小.
解答 解:①主族元素族序数=最外层电子数,主族元素包含金属元素与非金属元素,故①错误;
②氯化铝属于共价化合物,故②错误;
③同卤族元素自上而下单质熔沸点升高,ⅠA金属元素的熔沸点从上到下逐渐降低,故③正确;
④第三周期主族元素的离子半径,从左到右,阴离子的离子半径大于阳离子的离子半径,铝离子半径最小,故④错误.
故选D.
点评 本题考查结构性质位置关系、同主族性质递变规律等,难度不大,注意理解同主族单质熔沸点递变规律.

练习册系列答案
相关题目
14.下列各组物质,一定互为同系物的是( )
| A. | 符合同一通式的物质 | |
| B. | 含有相同官能团的物质 | |
| C. | 相对分子质量相差14或者14的倍数的物质 | |
| D. | 通式为CnH2n+2,且C原子数不相等的物质 |
15.在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Νι(ΧΟ)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2.下列说法正确的是( )
| A. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4百分含量将增大 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| C. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| D. | 上述生成Ni(CO)4(g)的反应为吸热反应 |
19.下列三种有机物是某些药物中的有效成分.以下说法正确的是( )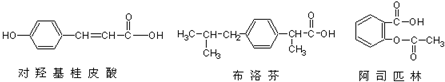

| A. | 三种有机物都能与浓溴水发生反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 将1mol 的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多 | |
| D. | 使用FeCl3溶液和稀硫酸不能鉴别出这三种有机物 |
9.由1,3-丁二烯合成2-氯-1,3-丁二烯的路线如下:该路线中各步的反应类型分别为( )


| A. | 加成、水解、加成、消去 | B. | 取代、水解、取代、消去 | ||
| C. | 加成、取代、取代、消去 | D. | 取代、取代、加成、氧化 |
13.下列过程能实现由化学能转化为热能的是( )
| A. | 碳酸钙受热分解 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | 铝粉与四氧化三铁反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
14.某元素X最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中X元素的化合价为( )
| A. | 5n-2 | B. | 3n-12 | C. | 3n-4 | D. | n-10 |
 +2Br2→
+2Br2→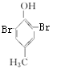 +2HBr
+2HBr
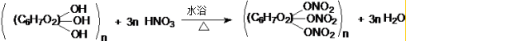 .
.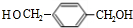 .
.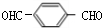 +2H2O.
+2H2O.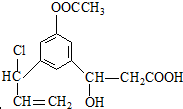 发生反应为①②③④⑤⑥
发生反应为①②③④⑤⑥