题目内容
8.用实验确定某酸HA是弱电解质.两同学的方案是:甲:①称取一定质量的HA配制0.1mol•L-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质.
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质.
(1)在两个方案的第①步中,都要用到定量仪器是100mL容量瓶.
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH>1(选填“>”、“<”、“=”).乙方案中,说明HA是弱电解质的现象是b.
a.装HCl溶液的试管中放出H2的速率快;
b.装HA溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快.
分析 (1)在两个方案的第①步中都要配置溶液,需要使用的定量仪器是100mL容量瓶;
(2)甲方案中,由于弱电解质只是部分电离,所以当HA是弱电解质时,其pH>1,乙方案中由于pH=1,所以在与纯度相同的锌粒时,由于弱电解质的电离,所以c(H+)较大,所以放出H2的速率快.
解答 解:(1)配制100ml一定物质的量浓度溶液时需要的定量仪器是100mL容量瓶,
故答案为:100mL溶量瓶;
(2)弱电解质存在电离平衡,不能完全电离,所以如果HA是弱电解质,则0.1mol/L溶液的pH就一定>1;
弱酸在稀释过程中会继续电离出阴阳离子,因此稀释相同的倍数后,HA溶液中氢离子的浓度大于盐酸中氢离子的浓度,所以装HA溶液的试管的中放出H2的速率快,即b正确,
故答案为:>;b.
点评 本题考查酸性强弱比较实验,是高考中的常见题型,试题难度不大,注意掌握判断酸性相对强弱的常用方法,该题有利于培养学生严谨的逻辑思维能力及化学实验能力,激发学生的学习兴趣.

练习册系列答案
相关题目
11.具有解热镇痛作用的药物是( )
| A. | 阿司匹林 | B. | 青霉素 | C. | NaHCO3 | D. | 麻黄碱 |
12.粗盐中含Ca2+、Mg2+、Fe3+、SO42-及泥沙等杂质,需要提纯后才能综合利用.粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加盐酸调节溶液的pH;⑤溶解;⑥过滤; ⑦蒸发.正确的操作顺序是( )
| A. | ⑤①③②④⑥⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤③①②⑥④⑦ | D. | ⑤③②①⑥④⑦ |
3.要验证甲烷中含有C、H元素,可将其完全燃烧产物依次通过:①浓硫酸②无水硫酸铜 ③澄清石灰水( )
| A. | ①②③ | B. | ②③ | C. | ②③① | D. | ③② |
13.下列标志中,应贴在装有乙醇罐车上的是( )
| A. |  | B. |  | C. |  | D. |  |
20.已知:①I2+SO2+2H2O═2HI+H2SO4;②2FeCl2+Cl2═2FeCl3;③2FeCl3+2HI═2FeCl2|+2HCl+I2,根据上述反应,判断下列说法正确的是( )
| A. | 氧化性强弱顺序是:Fe3+>Cl2>I2>SO42- | |
| B. | 还原性强弱顺序是:SO2>I->Fe2+>Cl- | |
| C. | 反应Cl2+SO2+2H2O═2HCl+H2SO4不能发生 | |
| D. | Fe3+与I-在溶液可以大量共存 |
17.某同学在实验报告中有以下实验数据,其中合理的是( )
| A. | 用量筒量取5.26ml盐酸 | |
| B. | 用托盘天平称取11.70g食盐 | |
| C. | 用PH试纸测得溶液的PH是3.5 | |
| D. | 用标准NaOH溶液滴定未知浓度的盐酸用去23.10ml NaOH溶液 |
18.下列有关离子的检验方法和判断正确的是( )
| A. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| D. | 向某溶液中滴加NaOH溶液,除溶液体积增大外,无其它现象,说明该溶液与NaOH溶液不反应. |
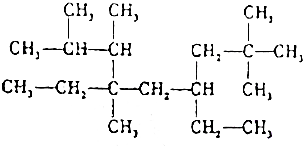 某烷结构如图所示,该烷主链碳原子数为9,该烷的名称为2,2,6,7,8-五甲基-4,6-二乙基壬烷.
某烷结构如图所示,该烷主链碳原子数为9,该烷的名称为2,2,6,7,8-五甲基-4,6-二乙基壬烷.