题目内容
【题目】某小组以CoCl36H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。

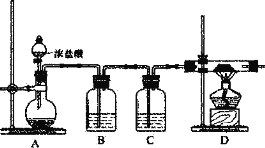
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mLc1 molL-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 molL-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是___。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用______式滴定管,可使用的指示剂为_______。
(3)样品中氨的质量分数表达式为_______。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将_____(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是_____;滴定终点时,若溶液中c(Ag+)=2.0×10-5 molL-1,c(CrO42-)为_____ molL-1。(已知:K sp(Ag2CrO4)=1.12×10-12)
(6)经测定,样品X中钴氨氯的物质的量之比为1:6:3,钴的化合价为_____,制备X的化学方程式为______;X的制备过程中温度不能过高的原因是_____。
【答案】当A中压力过大时,安全管中液面上升,使A瓶中压力稳定 碱 酚酞(或甲基红) ![]() ×100% 偏低 防止硝酸银见光分解 2.8×10-3 +3 2CoCl2+2NH4Cl+10NH3+H2O2
×100% 偏低 防止硝酸银见光分解 2.8×10-3 +3 2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
【解析】
(1)通过2中液面调节A中压强;
(2)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中;NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂;
(3)根据氨气和盐酸反应之间的关系式计算氨气的质量,再根据质量分数公式计算氨质量分数;
(4)若气密性不好,导致氨气的量偏低;
(5)硝酸银不稳定,易分解;根据离子积常数计算c(CrO42-);
(6)根据化合物中各元素化合价的代数和为0计算Co元素化合价;该反应中Co失电子、双氧水得电子,CoCl26H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水;温度高,双氧水易分解、气体的溶解度随着温度的升高而降低。
(1)通过导管2中液面调节A中压强,如果A中压力过大时,安全管中液面上升,使A中压力减小,从而使A瓶中稳定压力;
(2)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中,所以用NaOH标准溶液确定过剩的HCl时,应使用碱式滴定管盛放NaOH溶液;NaOH溶液和盐酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂,甲基红为酸性变色指示剂、酚酞为碱性变色指示剂,所以可以选取甲基红或酚酞作指示剂;
(3)与氨气反应的n(HCl)=10-3V1 L×c1 mol/L-c2 mol/L×10-3V2 L=10-3(c1·V1-c2·V2) mol,根据氨气和HCl的关系式知,n(NH3)=n(HCl)=10-3(c1·V1-c2·V2) mol,所以氨的质量分数=![]() ×100%;
×100%;
(4)若气密性不好,导致部分氨气泄漏,使氨气质量分数偏低;
(5)硝酸银不稳定,见光易分解,为防止硝酸银分解,用棕色试剂瓶盛放硝酸银溶液;Ksp(Ag2CrO4)=1.12×10-12,由于c(Ag+)=2.0×10-5 molL-1,所以c(CrO42-)= mol/L=2.8×10-3 mol/L;
mol/L=2.8×10-3 mol/L;
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,则其化学式为[Co(NH3)6]Cl3,根据化合物中各元素化合价的代数和为0,可知Co元素化合价为+3价;该反应中Co失电子、双氧水得电子,CoCl26H2O、NH4Cl、H2O2、NH3发生反应生成[Co(NH3)6]Cl3和水,反应方程式为2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O;双氧水温度高易分解、气体在溶液中的溶解度随着温度的升高而降低,所以X的制备过程中温度不能过高,否则温度越高过氧化氢分解、氨气逸出。
2[Co(NH3)6]Cl3+2H2O;双氧水温度高易分解、气体在溶液中的溶解度随着温度的升高而降低,所以X的制备过程中温度不能过高,否则温度越高过氧化氢分解、氨气逸出。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案