题目内容
17.将A与B置于2L的密闭容器中,发生以下反应2A(g)+3B(g)=C(g)+4D(g),反应进行到5min末,测得A为1mol,B为2mol,C为2mo1,则A的初始的物质的量为多少?A的转化率为多少?分析 由生成的C可以计算参加反应A的物质的量,A的起始物质的量=1mol+A反应的物质的量,A转化率=$\frac{反应A的物质的量}{A的初始物质的量}$×100%.
解答 解:将A与B置于2L的密闭容器中,反应进行到5min末,测得A为1mol,B为2mol,C为2mo1,由2A(g)+3B(g)=C(g)+4D(g),可知△n(A)=2△n(C)=4mol,
故A的初始的物质的量为1mol+4mol=5mol,
A的转化率为$\frac{4mol}{5mol}$×100%=80%,
答:A的初始的物质的量为5mol,A的转化率为80%.
点评 本题考查化学平衡的有关计算,比较基础,旨在考查学生对基础知识的掌握.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
3.甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合如图.其中甲和X可能是( )
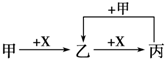

| A. | 甲为Fe、X为Cl2 | B. | 甲为S、X为O2 | ||
| C. | 甲为SO2、X为NaOH溶液 | D. | 甲为AlCl3溶液、X为NH3•H2O |
4.下列方程式中电子转移数目正确的是( )
| A. | 3NO2+H20═2HNO3+NO,转移3e- | |
| B. | 2KMnO4+10FeSO4+8H2SO4═K2SO4+5Fe2(SO4)3+2MnSO4+8H20,转移5e- | |
| C. | KClO3+6HCl═KCl+3Cl2↑+3H20,转移6e- | |
| D. | I2+SO2+2H20═H2SO4+2HI,转移2e- |
12.将等物质的量的A、B混合于1L的密闭容器中,发生反应:2A(g)+B(g)?2C(g)+D(?),5min时,测得密闭容器内气体压强减小,且c(A):c(B)=3:4,5min内,v(A)=0.2mol•L-1•minL-1,下列有关结论正确的是( )
| A. | D为气体 | B. | B的转化率为80% | ||
| C. | 5min时,c(A)=1.5mol•L-1 | D. | 反应开始前A的物质的量为2mol |
9.工业生产硝酸的第一步反应为4NH3(g)+5O2(g)?4NO(g)+6H2O(g),△H<0,保持一定温度不变,在体积为1L的恒容密闭容器中发生上述可逆反应,下表记录的是不同时间容器内各物质的物质的量
0~2min内的反应速率v(NH3)=0.1mol/(L.min),该温度下,上述可逆反应的平衡常数K=11.4.
| 物质的量(mol) 时间(min) | n(NH3) | n(O2) | n(H2O) |
| 0 | 2.00 | 2.25 | 0 |
| 第2min | 1.80 | 2.00 | 0.30 |
| 第4min | 1.60 | 1.75 | 0.60 |
| 第6min | 1.00 | 1.00 | 1.50 |
| 第8min | 1.00 | 1.00 | 1.50 |
6.下列装置所示的实验中,能达到实验目的是( )
| A. |  从Mg(OH)2悬浊液中分离出Mg(OH)2 | B. |  除去Cl2中的HCl | ||
| C. | 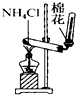 实验室制氨气 | D. | 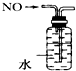 排水法收集NO |
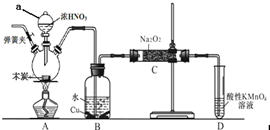 亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).
亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).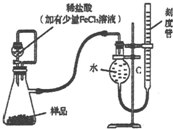 过氧化镁MgO2易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常混有少量MgO,实验室可通过多种方案测定样品过氧化镁的含量.
过氧化镁MgO2易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等.过氧化镁产品中常混有少量MgO,实验室可通过多种方案测定样品过氧化镁的含量. .
.