题目内容
【题目】下表为元素周期表的一部分,参照元素①-⑧在表中的位置,请回答下列问题。
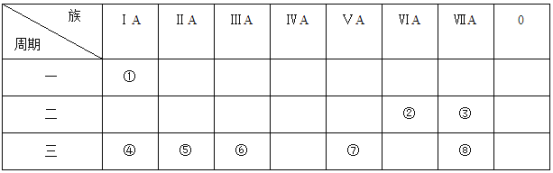
(1)元素③单质的化学式为___________,①和④两种元素形成化合物的电子式为_________。由①②组成且含有非极性键的物质的结构式为____________。
(2)④-⑧5种元素所形成的最高价氧化物的水化物中,碱性最强的是_________,酸性最强的是___________,属于中强酸的是_________(均填化学式)。
(3)④和⑥两种元素的最高价氧化物的水化物,在水中反应的离子方程式为____________。
【答案】 F2 Na+[:H]— H—O—O—H NaOH HClO4 H3PO4 Al(OH)+OH—=AlO2—+H2O
【解析】根据元素在周期表中的位置可知,①为H元素,②为O元素,③为F元素,④为Na元素,⑤为Mg元素,⑥为Al元素,⑦为P元素,⑧为Cl元素,结合元素周期律的内容分析解答。
(1)元素③单质的化学式为F2,①和④两种元素形成化合物为氢化钠,属于离子化合物,电子式为Na+[:H]—。由①②组成且含有非极性键的物质为过氧化氢,结构式为H—O—O—H,故答案为:F2;Na+[:H]—;H—O—O—H;
(2)元素的金属性越强,最高价氧化物的水化物的碱性越强,元素的非金属性越强,最高价氧化物的水化物的酸性越强,④-⑧5种元素所形成的最高价氧化物的水化物中,碱性最强的是NaOH,酸性最强的是HClO4,属于中强酸的是H3PO4,故答案为:NaOH;HClO4;H3PO4;
(3)④和⑥两种元素的最高价氧化物的水化物分别为氢氧化钠和氢氧化铝,氢氧化铝为两性氢氧化物,在水中反应的离子方程式为Al(OH)+OH—=AlO2—+H2O,故答案为:Al(OH)+OH—=AlO2—+H2O。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案