题目内容
【题目】写出下列反应的热化学方程式:
(1)N2和H2反应生成34g NH3 , 放出92kJ热量。
(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量。
【答案】
(1)N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92kJ/mol
2NH3(g) ΔH=-92kJ/mol
(2) CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
【解析】(1)34gNH3的物质的量为:34g÷17gmol-1=2mol,N2与H2反应生成生成2molNH3,放热92kJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92kJ/mol。(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol。
2NH3(g) ΔH=-92kJ/mol。(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量,标注物质聚集状态和对应反应焓变写出热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】SOCl2是一种重要氯化剂、锂电池的正极材料,还可作水合盐酸盐的脱水剂。
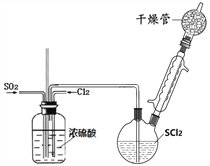
Ⅰ.一种模拟制备SOCl2装置如上图所示(夹持、加热装置略去),双颈瓶中加入25.4mL SCl2,通入纯净干燥Cl2、SO2混合气体,水浴条件下发生反应Cl2+SO2+SCl2=2SOCl2,几种物质的部分性质如下表所示:
密度/ g﹒mL-1 | 熔点/℃ | 沸点/℃ | 备注 | |
SCl2 | 1.62 | -122 | 59 | 40℃分解,遇水分解 |
SOCl2 | 1.64 | -104.5 | 76 | 76℃分解,遇水分解 |
(1)洗气瓶将气体混合并干燥,还有___________作用。
(2)干燥管中碱石灰作用__________。
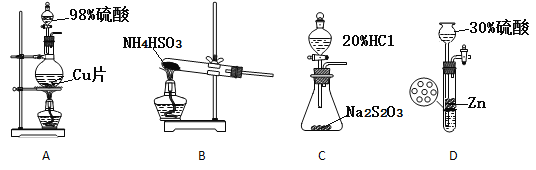
(3)实验室制取SO2装置和药品应选择____。
Ⅱ、双颈瓶换毛细玻璃管和蒸馏头,连接减压蒸馏装置,对粗产品减压初蒸,剩余液体继续减压蒸馏获得产品
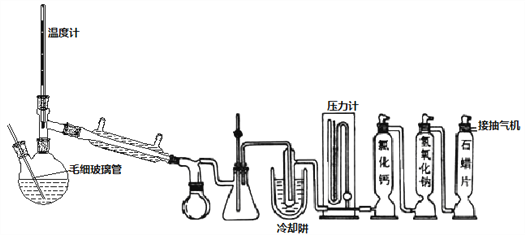
(4)不能用普通蒸馏方法分离混合物的原因是____。
(5)毛细玻璃管C作用是____________。初蒸水浴加热的温度应控制在____℃以下,再蒸馏获得产品25.4mL,则SOCl2产率为__________。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=。
(2)该反应为(填“吸热”或“放热”)反应。