题目内容
16.在N2+3H2?2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4mol•L-1,则以氨气的浓度变化表示该反应在2s内的平均反应速率是( )| A. | 0.1mol•L-1•S-1 | B. | 0.4 mol•L-1•S-1 | C. | 0.2 mol•L-1•S-1 | D. | 0.6mol•L-1•S-1 |
分析 该反应中△c(NH3)=(0.4-0)mol/L=0.4mol/L,△t=2s,根据v=$\frac{△c}{△t}$计算氨气的平均化学反应速率,据此分析解答.
解答 解:反应中△c(NH3)=(0.4-0)mol/L=0.4mol/L,△t=2s,v(NH3)=$\frac{△c}{△t}$=$\frac{0.4mol/L}{0.2s}$=0.2 mol•L-1•S-1,故选C.
点评 本题考查化学反应速率定量表示方法,为基础题,明确公式中各个物理量之间的关系即可解答,题目难度不大.

练习册系列答案
相关题目
7.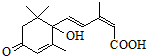 对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
 对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )| A. | 含有碳碳双键、苯环、羟基、羰基 | |
| B. | 含有碳碳双键、羟基、羰基、羧基 | |
| C. | 1 mol该物质能与5 mol H2发生加成反应 | |
| D. | 与等物质的量的溴单质发生加成反应可得3种产物 |
4.下列关于苯的说法中,不正确的是( )
| A. | 苯不溶于水,可以作为萃取剂将溴从水中分离出来 | |
| B. | 分子中含有三个C-C键和三个C=C键 | |
| C. | 分子中C、H元素的质量比为12:1 | |
| D. | 在空气中燃烧时产生浓烟 |
11.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )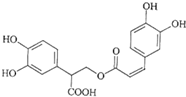

| A. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| B. | 1mol迷迭香酸最多能和8mol氢气发生加成反应 | |
| C. | 1mol迷迭香酸与NaOH的水溶液完全反应时最多消耗5molNaOH | |
| D. | 迷迭香酸属于芳香烃 |
1.下列各组混合物中,可以用分液漏斗分离的是( )
| A. | 酒精和水 | B. | 乙酸和乙醇 | C. | 苯和水 | D. | 溴苯和苯 |
8.生活中处处有化学,下列有关说法正确的是( )
| A. | 淀粉和纤维素均为天然高分子化合物 | |
| B. | 饮用矿泉水瓶的主要成分是聚氯乙烯 | |
| C. | 凡含有食品添加剂的食物均不可食用 | |
| D. | 大米煮成粥后,淀粉就变成了葡萄糖 |
5.下列说法中正确的是( )
| A. | 丙烯分子中有8个σ键,1个π键 | |
| B. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键? | |
| C. | NCl3和BCl3分子中,中心原子都采用sp3杂化 | |
| D. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
6.下列叙述不正确的是( )
| A. | 将废弃的含铅、汞电子产品掩埋地下,防止污染环境 | |
| B. | 大力发展氢能源汽车减少碳排放 | |
| C. | 控制卤代烃的使用,减少对臭氧层的破坏 | |
| D. | 大力发展核能,减少化石能源的使用,有利于保护环境 |