题目内容
【题目】已知25℃和101kPa时
①CO(g)+ ![]() O2(g)═CO2(g)△H1=﹣a kJ/mol
O2(g)═CO2(g)△H1=﹣a kJ/mol
②H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣b kJ/mol
O2(g)═H2O(l)△H2=﹣b kJ/mol
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=﹣c kJ/mol
(1)试计算2CO(g)+4H2(g)═H2O(l)+C2H5OH(l)的△H= .
(2)对反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法 不正确的是________
A.A、C两点的反应速率:A<C
B.B、C两点的气体的平均相对分子质量:B>C
C.A、C两点气体的颜色:A深,C浅
D.由状态A到状态B,可以用降温的方法
(3)在100℃时,将0.50mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
①上述条件下,前20秒二氧化氮的平均反应速率为 ,平衡时二氧化氮的转化率为 .
②该温度下,反应的平衡常数K值为 .(保留一位小数)
(4)甲醇﹣空气的燃料电池(电解质为KOH溶液)得到广泛应用,请写出该燃料电池负极的电极反应式 ,若通入空气之前电解质KOH溶液的浓度为0.6mol/L,体积为100mL,当电子转移0.15mol后电解质溶液的pH为 .(体积保持不变,室温条件)
(5)电离度指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数的百分数.若室温下,c mol/L氨水的电离平衡常数为Kb , 则该氨水的电离度 α= .(请用c和Kb表示,可进行近似计算)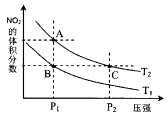
【答案】
(1)﹣(2a+4b﹣c)kJ/mol
(2)B,C
(3)0.0025mol/(L?s);40%;2.2
(4)CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O;13
(5)![]()
【解析】解:(1)已知:①CO(g)+ ![]() O2(g)═CO2(g)△H1=﹣a kJ/mol
O2(g)═CO2(g)△H1=﹣a kJ/mol
②H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣b kJ/mol
O2(g)═H2O(l)△H2=﹣b kJ/mol
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=﹣c kJ/mol,
根据盖斯定律,①×2﹣③+②×4得:2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)△H.4=2△H1﹣△H3+4△H2=2×(﹣akJ/mol)﹣(﹣ckJ/mol)+4×(﹣bkJ/mol)=﹣(2a+4b﹣c)kJ/mol,
所以答案是:﹣(2a+4b﹣c)kJ/mol;(2)A.由图象可知,A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,故A正确;
B.B、C两点二氧化氮的体积分数相同,则气体的平均相对分子质量:B=C,故B错误;
C.由图象可知,A、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比A的浓度高,NO2为红棕色气体,则A、C两点气体的颜色:A浅,C深,故C错误;
D.降低温度,化学平衡逆向移动,NO2的体积分数减小,由图象可知,A点NO2的体积分数大,则T1<T2 , 由状态A到状态B,可以用降温的方法,故D正确;
所以答案是:BC;(3)发生反应
2NO2(g) | N2O4(g) | |
反应前(mol) | 0.50 | 0 |
转化 (mol) | 0.20 | 0.10 |
平衡时(mol) | 0.30 | 0.10 |
①前20秒N2O4的平均反应速率为v(N2O4)= ![]() =0.00125mol/(Ls),化学反应速率与化学计量数成正比,则v(NO2)=2v(N2O4)=0.0025mol/(Ls);
=0.00125mol/(Ls),化学反应速率与化学计量数成正比,则v(NO2)=2v(N2O4)=0.0025mol/(Ls);
平衡时二氧化氮的转化率为: ![]() ×100%=40%,
×100%=40%,
所以答案是:0.0025mol/(Ls);40%;②该温度下,达到平衡时c(N2O4)= ![]() =0.05mol/L、c(NO2)=
=0.05mol/L、c(NO2)= ![]() =0.15mol/L,该反应的平衡常数K=
=0.15mol/L,该反应的平衡常数K= ![]() ≈2.2,
≈2.2,
所以答案是:2.2;(4)甲醇﹣空气燃料电池中燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,C的化合价有﹣2价变为+4价,每摩C转移6摩电子,依据电荷守恒和原子守恒,写出电极反应式,电极反应式为:CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O,氧气在正极得到电子发生还原反应,电极反应为:O2+2H2O+4e﹣=4OH﹣ , 电极总反应为:2CH3OH+3O2+4OH﹣=2CO32﹣+6H2O,根据反应可知,当电子转移0.15mol后消耗KOH的物质的量为:0.15mol× ![]() =0.05mol,则反应后溶液中氢氧根离子浓度为:0.6mol/L﹣
=0.05mol,则反应后溶液中氢氧根离子浓度为:0.6mol/L﹣ ![]() =0.1mol/L,所以反应后溶液的pH=13,
=0.1mol/L,所以反应后溶液的pH=13,
所以答案是:CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O;13;(5)设电离的一水合氨为x,则
NH3 . H2O | NH4++ | OH﹣ , | |
起始 | c | 0 | 0 |
转化 | X | X | X |
| <>平衡 | c-x | X | x |
则:Kb= ![]() ,解得:x=
,解得:x= ![]() ,
,
则该氨水的电离度a= ![]() =
= ![]() =
= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】根据题目的已知条件,利用反应热和焓变和化学平衡的计算的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 阅读快车系列答案
阅读快车系列答案【题目】已知1mol燃料完全燃烧的数据分别为:
燃料 | 一氧化碳 | 甲烷 | 异辛烷(C8H18) | 乙醇 |
△H | ﹣283.0kJmol﹣1 | ﹣891.0kJmol﹣1 | ﹣5461.0kJmol﹣1 | ﹣1366.8kJmol﹣1 |
使用上述燃料.最能体现“低碳经济”理念的是( )
A.一氧化碳
B.甲烷
C.异辛烷
D.乙醇