��Ŀ����
��һ���Ϊ10 L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��
CO(g)+H2O(g)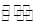 CO2(g)+H2(g) ��H<0��
CO2(g)+H2(g) ��H<0��
��1��CO��H2OŨ�ȱ仯��ͼ�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K= ��
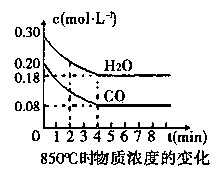
0��4 min��ƽ����Ӧ����v(CO)= mol��L-1��min-1���������¶ȣ��÷�Ӧ��Kֵ�� ���÷�Ӧ�Ļ�ѧ��Ӧ���ʽ� (�������С�����䡱)��
��2������ͬ�����з���������Ӧ�����¶ȸ���850��ʱ�������ڸ����ʵ�Ũ�ȱ仯���±���
�ٱ���3 min~4 min֮�䷴Ӧ���� ״̬��cl��ֵ 0��08 mol��L-1(����ڡ�С�ڻ����)��
�ڷ�Ӧ��4 min~5 min֮�䣬ƽ�����淽���ƶ������ܵ�ԭ����
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ��
��3������ͬ�¶���(850��)������ʼʱc(CO)=1mol��L-1��C(H2O)=2mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5 mol��L-1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬ (��ǡ��롰��)����ʱv(��) v(��)(����ڡ���С�ڡ����ڡ�)�����жϵ������� ��
CO(g)+H2O(g)
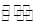 CO2(g)+H2(g) ��H<0��
CO2(g)+H2(g) ��H<0����1��CO��H2OŨ�ȱ仯��ͼ�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K= ��

0��4 min��ƽ����Ӧ����v(CO)= mol��L-1��min-1���������¶ȣ��÷�Ӧ��Kֵ�� ���÷�Ӧ�Ļ�ѧ��Ӧ���ʽ� (�������С�����䡱)��
��2������ͬ�����з���������Ӧ�����¶ȸ���850��ʱ�������ڸ����ʵ�Ũ�ȱ仯���±���
| ʱ��(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
�ٱ���3 min~4 min֮�䷴Ӧ���� ״̬��cl��ֵ 0��08 mol��L-1(����ڡ�С�ڻ����)��
�ڷ�Ӧ��4 min~5 min֮�䣬ƽ�����淽���ƶ������ܵ�ԭ����
a������ˮ���� b�������¶� c��ʹ�ô��� d����������Ũ��
��3������ͬ�¶���(850��)������ʼʱc(CO)=1mol��L-1��C(H2O)=2mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5 mol��L-1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬ (��ǡ��롰��)����ʱv(��) v(��)(����ڡ���С�ڡ����ڡ�)�����жϵ������� ��
��1��1 0.03 ���� ��С
��2����ƽ�� ���� ��d
��3���� ����
��Ϊ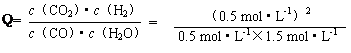
 ��K����Ӧ���ҽ��С�
��K����Ӧ���ҽ��С�
��2����ƽ�� ���� ��d
��3���� ����
��Ϊ
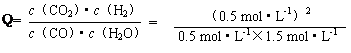
 ��K����Ӧ���ҽ��С�
��K����Ӧ���ҽ��С������������1����ͼ����֪��CO��H2OŨ���ڴﵽƽ��ʱ��Ũ�ȷֱ�Ϊ0.08 mol/L��0.18mol/L����Ӧ���ɵ�CO2��H2��Ϊ0.12mol/L�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K=0.12��0.12/��0.08��0.18��=1��0��4min��ƽ����Ӧ����v(CO)����0.20-0.08��/4=0.03mol��L-1��min-1����H<0��˵���÷�ӦΪ���ȷ�Ӧ�����Խ����¶ȣ��÷�Ӧ��Kֵ�������¶Ƚ��ͣ���ѧ��Ӧ���ʼ�С��
��2����Ϊ3min��4min�����ʵ�Ũ����ȣ�����3min��4min֮�䷴Ӧ����ƽ��״̬��c 1��ֵ����0.08 mol��L-1����Ϊǰ�����ӵ�CO��ѧ��Ӧ����Ϊ��0.200-0.138��/2=0.031mol��L-1��min-1������һ����ӦŨ�ȼ��٣���ѧ��Ӧ����Ҳ���٣���c 1��ֵ����ֵΪ0.08 mol��L-1��������2-3min��ƽ����ѧ����Ϊ��0.138-0.08��/1=0.058mol��L-1��min-1����������Dz����ܷ����ģ�����c 1��ֵ����0.08 mol��L-1��
�ڷ�Ӧ��4min��5min�䣬ƽ�����淽���ƶ������ܵ�ԭ����Ϊ��������Ũ�ȣ���Ϊ�����Ũ�Ⱦ�������Ӧ��֮һ��CO��Ũ�ȼ��٣�������������Ũ�ȣ��ʱ���Ĵ�ѡ��d��
��3������ͬ�¶��£�850�棩��ƽ�ⳣ��Ϊ1����Ϊ
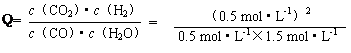 =
=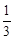 ��K=1�����Ը÷�Ӧδ�ﵽ��ѧƽ�⣬��ʱv������>v���棩����Ӧ���ҽ��С�
��K=1�����Ը÷�Ӧδ�ﵽ��ѧƽ�⣬��ʱv������>v���棩����Ӧ���ҽ��С�
��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
 FeO(s)+CO(g) ��H>0��
FeO(s)+CO(g) ��H>0�� CO(g)+H2(g)���Է����ͻش��������⣺
CO(g)+H2(g)���Է����ͻش��������⣺ CO(g)+H2(g)�������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ��������Ӧ�����ƶ�
CO(g)+H2(g)�������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ��������Ӧ�����ƶ�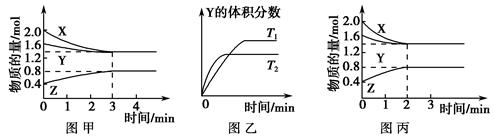
 2Z(g)
2Z(g) H++Cl-+HClO������˵������ȷ����(����)
H++Cl-+HClO������˵������ȷ����(����)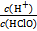 ����
���� CaSO4��2H2O(s)+2 OH��
CaSO4��2H2O(s)+2 OH��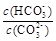 ��С
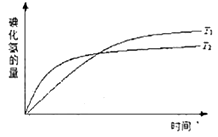
��С 2HI(g)�����¶�T1��T2ʱ����������뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ������ͼʾ����ȷ�ж���
2HI(g)�����¶�T1��T2ʱ����������뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ������ͼʾ����ȷ�ж���