题目内容
【题目】下图是实验室制取NH3的气体发生装置,请结合所学知识,回答下列问题:

(1)图中用于加热的仪器名称是__________,收集的方法是________________法,验证是否已经收集满的方法是______________________________(任写一种)。
(2)写出实验室制取NH3的化学方程式:________________________________________。
(3)若有5.35 g氯化铵参加反应,则产生的在标准状况下的体积为________L。
【答案】 酒精灯 向下排空气 用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 2.24L
CaCl2+2NH3↑+2H2O 2.24L
【解析】试题分析:(1)用于加热的仪器是酒精灯,根据氨气易溶于水、密度小于空气选择收集方法,氨气能使湿润的红色石蕊试纸变蓝。
(2)实验室用氯化铵和氢氧化钙加热制取NH3。
(3)根据化学方程式计算氨气标准状况下的体积。
解析:(1)用于加热的仪器是酒精灯,氨气易溶于水、密度小于空气所以用向下排空气法收集,氨气能使湿润的红色石蕊试纸变蓝,验证是否已经收集满的方法是用湿润的红色石蕊试纸靠近瓶口,若变蓝色,说明收集满瓶。
(2)实验室用氯化铵和氢氧化钙加热制取NH3,方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 。
CaCl2+2NH3↑+2H2O 。
(3)设生成氨气标准状况下的体积vL;
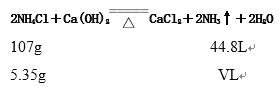
![]() v= 2.24L
v= 2.24L

 阅读快车系列答案
阅读快车系列答案【题目】L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如下表,L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料。
M | |
T |
请回答下列问题:
(1)T离子的结构示意图为__________,元素W在周期表中位于第______族,M单质分子的电子式为__________。
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶盛放氢氧化钠溶液的原因是(用化学方程式表示)__________。
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)__________。
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可用于工业炼铁。制备RW4的化学方程式为______________________________。

