题目内容
【题目】原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
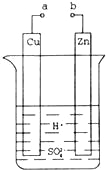
(1)a和b不连接时,烧杯中发生反应的离子方程式是
(2)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),电极反应式是;Zn极发生 (填“氧化”或“还原”)反应,溶液中H+移向 (填“Cu”或“Zn”)极.
(3)a和b用导线连接,若Zn片质量减轻了6.5g,则另一极上理论上产生气体 L(标况下).
(4)有同学向把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 .
【答案】(1)Zn+2H+=Zn2++H2↑;
(2)正;2H++2e﹣=H2↑;氧化;Cu;
(3)2.24L;
(4)否;此反应为非氧化还原反应,且反应吸热.
【解析】
试题分析:(1)a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应;
(2)a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电解质溶液中阳离子向正极移动;
(3)根据锌与转移电子之间的关系式计算;
(4)能设计成原电池的化学反应必须是能自发进行的放热的氧化还原反应.
解:(1)a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(2)a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e﹣=H2↑;锌失电子发生氧化反应而作负极,放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:正;2H++2e﹣=H2↑;氧化;Cu;
(3)电子转移关系为:Zn~2e﹣~H2,锌片减少的质量为6.5g,其物质的量为0.1mol,产生氢气为0.1mol,在标况下的体积为2.24L,
故答案为:2.24L;
(4)该反应不是氧化还原反应,且是吸热反应,所以不能设计成原电池,
故答案为:否;此反应为非氧化还原反应,且反应吸热.

 精英口算卡系列答案
精英口算卡系列答案