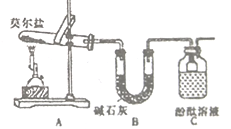
题目内容
【题目】填空
(1)发射卫星可用气态肼为燃料,肼的分子式为N2H4 , 肼的电子式为 .
(2)“西气东输”中的“气”指天然气,其主要成分的结构式是 . 一定量的该气体反应过程的能量变化如图所示,该反应为(填“放热”或“吸热”)反应.25℃,101kPa时,1mol该气体在氧气中燃烧放出热量为akJ,该气体燃烧的热化学方程式为 . 
【答案】
(1)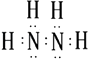
(2) ;放热;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣aKJ/mol
;放热;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣aKJ/mol
【解析】解:(1)肼的分子式为N2H4 , 是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,电子式为: 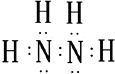 ,
,
所以答案是: 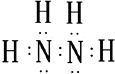 ;(2)天然气主要成分为甲烷,是一个碳原子和四个氢原子形成的正四面体结构,结构式为:
;(2)天然气主要成分为甲烷,是一个碳原子和四个氢原子形成的正四面体结构,结构式为:  ,图象中反应物能量高于生成物为放热反应,书写热化学方程式标注物质的聚集状态和对应反应的焓变,25℃,101kPa时,1mol该气体在氧气中燃烧放出热量为akJ,该气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣aKJ/mol,
,图象中反应物能量高于生成物为放热反应,书写热化学方程式标注物质的聚集状态和对应反应的焓变,25℃,101kPa时,1mol该气体在氧气中燃烧放出热量为akJ,该气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣aKJ/mol,
所以答案是:  ;放热;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣aKJ/mol.
;放热;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣aKJ/mol.
【考点精析】根据题目的已知条件,利用反应热和焓变的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热.

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案【题目】下表是元素周期表的一部分,回答下列有关问题:(用元素符号或化学式填空)
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ① | ② | |||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
(1)写出元素①最高价氧化物的电子式_________;元素⑦的离子结构示意图__________。
(2)在这些元素的最高价氧化物的水化物中,酸性最强的是_________。
(3)写出⑤最高价氧化物的水化物的电离方程式是___________________。
(4)写出元素③的最高价氧化物的水化物和元素⑤的最高价氧化物反应的离子方程式_________。
(5)在④与⑦中,离子半径较小的是_____________________。
(6)在②和⑥中,化学性质较活泼的是______,用一个化学方程式表示______________。