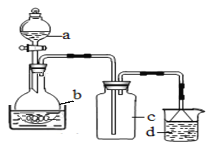
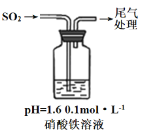
题目内容
【题目】常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/LCH3COOH溶液和 HCN 溶液所得滴定曲线如图[Ka(CH3COOH)>Ka(HCN)]。下列说法正确的是
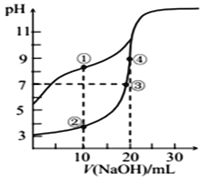
A.点①和点②所示溶液中:c(CH3COO﹣)<c(CN﹣)
B.点①和点②所示溶液中:c(CH3COO﹣)-c(CN﹣) = c(HCN)-c(CH3COOH)
C.溶液中水的电离程度:③>④
D.点③和点④所示溶液中都有:c(CH3COO﹣)+c(OH﹣) = c(CH3COOH)+c(H+)
【答案】B
【解析】
A. 根据图知,0.10 molL1的CH3COOH溶液和HCN溶液的pH:CH3COOH<HCN,所以两种酸中c(H+):CH3COOH>HCN,酸性CH3COOH>HCN,酸根离子水解程度:CH3COO<CN,则点①和点②所示溶液中。c(CH3COO)>c(CN),故A错误;
B. ①②点溶液中加入的酸的物质的量相等,且溶液体积相等,根据物料守恒得c(CH3COO)+c(CH3COOH) = c(CN)+c(HCN),所以得c(CH3COO)-c(CN)=c(HCN)-c(CH3COOH),故B正确;
C. 点③呈中性,溶质为CH3COOH和CH3COONa,水解程度和酸电离程度相等,点④溶质CH3COONa,单一水解,因此水的电离程度为④>③,故C错误;
D. 点③溶质为CH3COOH和CH3COONa,根据电荷守恒得c(CH3COO)+c(OH) = c(Na+)+c(H+),溶液呈中性,因此有c(CH3COO) = c(Na+),无法得出c(CH3COO)+c(OH) = c(CH3COOH)+c(H+),点④溶质CH3COONa,根据电荷守恒得c(CH3COO)+c(OH) = c(Na+)+c(H+),根据物料守恒得到c(CH3COO)+ c(CH3COOH) = c(Na+),无法得出c(CH3COO)+c(OH) = c(CH3COOH)+c(H+),故D错误。
综上所述,答案为B。

 三新快车金牌周周练系列答案
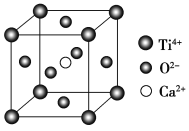
三新快车金牌周周练系列答案【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道;Si、P、S第一电离能由小到大顺序是__。
(2)碳和硅的有关化学键键能如表所示:
化学键 | CC | CH | CO | SiSi | SiH | SiO |
键能/kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___。
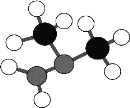
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
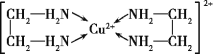
该配离子中含有的化学键类型有__(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__个σ键,C原子的杂化方式为__。
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__,与Ti4+距离最近且相等的O2-有__个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。