题目内容
【题目】Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
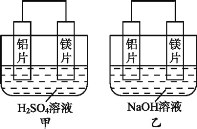
(1)写出甲中正极的电极反应式:____。
(2)乙中负极为__,总反应的离子方程式:___。
(3)由此实验得出的下列结论中,正确的有____。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
Ⅱ.化学电池在通信、交通及日常生活中有着广泛的应用。目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
①放电时Cd作正极 ②放电时Ni元素被还原
③充电时化学能转变为电能 ④放电时化学能转变为电能
Ⅲ.氢气和氧气可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式(当电解质溶液为NaOH(aq)或KOH(aq)时)两种。试回答下列问题:
(1)酸式电池的电极反应:正极_____;
(2)碱式电池的电极反应:负极_______。
【答案】2H++2e-H2↑ Al 2Al+2OH-+2H2O2AlO2-+3H2↑ AD ②④ O2+4e-+4H+2H2O 2H2-4e-+4OH-4H2O
【解析】
Ⅰ.甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,镁作正极,正极发生还原反应,通过对比甲乙实验可知,电解质溶液的酸碱性可能影响电极反应式,电池的正负极判断除了与金属活动性顺序有关,还与电解质有关,据此分析作答;
Ⅱ.根据总反应式结合原电池与电解池的工作原理作答;
Ⅲ. 正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合生成H2O,碱性条件下与H2O分子结合生成OH-;负极上,酸性条件下H2失电子变为H+,H+进入电解质溶液;碱性条件下H+不能大量存在,与OH-结合生成水。两种环境下电池总反应均是H2和O2生成水的反应。
Ⅰ.根据原电池原理可知,甲中总反应是镁与稀硫酸反应生成硫酸镁与氢气,镁作负极发生失电子的氧化反应,正极上氢离子得电子发生还原反应,其电极反应式为:2H++2e-=H2↑;
(2)乙中铝与氢氧化钠和水发生氧化还原反应,因此铝作该电池的负极,总的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)
A. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质,如酸性条件下活泼金属做负极,而碱性条件下就不一定,A项正确;
B. 镁的金属性比铝的金属性强,B项错误;
C.该实验说明金属活动性顺序表主要指的是酸性条件下金属的还原性,C项错误;
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析,D项正确;
答案选AD;
Ⅱ.电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,则,
2Ni(OH)2+Cd(OH)2,则,
①放电时,Cd转化为Cd(OH)2,元素化合价升高,发生失电子的氧化反应,作原电池的负极,①项错误;
②放电时,Ni元素从+3价降低到+2价,元素被还原,②项正确;
③充电过程利用的是电解池的工作原理,是将电能转化为化学能,③项错误;
④放电过程利用的是原电池的工作原理,是将化学能转变为电能,④项正确;
综上所述,②④项正确,答案为:②④;
Ⅲ. 根据上述分析可知,
(1)酸式电池正极上O2得电子转化为H2O,其电极反应式为:O2+4e-+4H+=2H2O;
(2)碱式电池负极氢气失电子转化为水,其电极反应式为:2H2-4e-+4OH-=4H2O。

 名校课堂系列答案
名校课堂系列答案【题目】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。
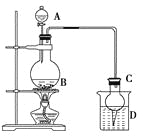
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点如下:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:_____________________________________________________________________。
(2)球形干燥管C的作用是______________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)__________________________________________;
反应结束后D中的现象是_______________________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入________(此空从下列选项中选择),然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰