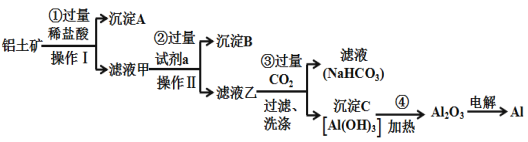
题目内容
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
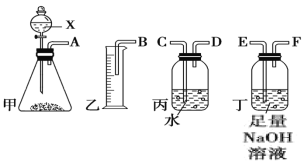
(1)实验室制乙炔的化学反应方程式_____________________________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用________________;
(4)装置丁的作用是____________________
(5)如果乙中收集到水的体积为V mL,电石质量为m g,则电石的纯度为_____________。(体积已换算成标准状况下体积)
【答案】CaC2+2H2O→Ca(OH)2+C2H2↑ AEFDCB 饱和食盐水 吸收杂质H2S ![]() %
%
【解析】
在实验室中一般是用电石与水反应制取乙炔,该反应非常剧烈,为使反应进行比较平缓,常用饱和食盐水代替水制取乙炔。由于电石中混有CaS杂质,CaS与水反应产生H2S气体,使乙炔有难闻的气味,可根据氢硫酸是酸,能与碱发生中和反应的性质,用NaOH溶液进行除杂处理,净化后的乙炔气体用排水方法收集,通过测量乙炔排出水的体积可确定乙炔的体积,再根据物质转化关系就可计算电石中碳化钙的含量。
(1)在实验室中一般是用电石与水反应制取乙炔,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)进行实验时,在装置甲中制取乙炔气体,由导管A导出,然后由导管E进入装置丁除去C2H2中的杂质H2S,净化后的C2H2气体经F导管排出,再经导气管D存储中丙装置中,装置中的水则由导管C排出,通过B导管进入量筒中,在相同温度、压强下,排出水的体积等于进入丙装置中的乙炔的体积,因此所制气体按气流从左向右流顺序,仪器的正确连接顺序是AEFDCB;
(3)由于电石与水制取乙炔的反应非常剧烈,为了使实验中气流平稳,通常用饱和食盐水代替水,以降低单位体积内水的含量,所以甲中分液漏斗里的液体X是饱和食盐水;
(4)装置丁的作用是吸收C2H2中杂质H2S;
(5)乙中收集到水的体积为V mL,其体积等于乙炔气体的体积,则反应产生乙炔的物质的量n(C2H2)=![]() mol,根据方程式CaC2+2H2O→Ca(OH)2+C2H2↑可知CaC2与C2H2的物质的量相等,所以电石中CaC2的质量为m(CaC2)=
mol,根据方程式CaC2+2H2O→Ca(OH)2+C2H2↑可知CaC2与C2H2的物质的量相等,所以电石中CaC2的质量为m(CaC2)=![]() mol ×64 g/mol=
mol ×64 g/mol=![]() g,由于电石样品质量为m g,所以该电石的纯度为
g,由于电石样品质量为m g,所以该电石的纯度为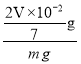 ×100%=
×100%=![]() %。
%。

【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
【题目】已知X、Y、Z均为主族元素,分析表中数据,判断下列说法正确的是(a≠b)( )
元素 | X | Y | Z |
最外层电子数 | a | b | a |
原子半径/nm | 0.154 | 0.130 | 0.211 |
A.X与Y位于同一主族,且X在Y的上一周期
B.X与Z位于同一主族,且X在Z的下一周期
C.X与Z位于同一周期,且X的原子序数小于Z的原子序数
D.X与Z位于同一主族,且X的原子序数小于Z的原子序数
【题目】有![]() 、
、![]() 、
、![]() 三种晶体,分别由
三种晶体,分别由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
晶体 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 |
| 801 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| 3500 | 很大 | 不溶 | 不导电 | 不反应 |
|
| 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为![]() ______;
______;![]() ______。
______。
(2)晶体的类型分别为![]() ______;
______;![]() ______,
______,![]() ______。
______。
(3)![]() 、
、![]() 晶体中粒子间的作用力分别为______、______。
晶体中粒子间的作用力分别为______、______。