题目内容
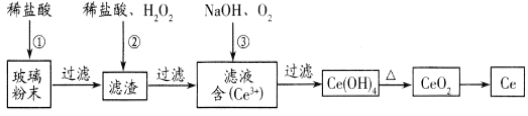
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料.工业上提取铝的工艺流程如下:
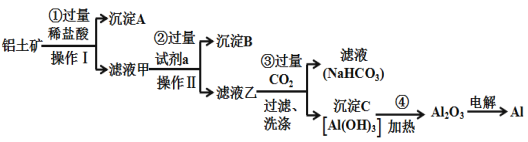
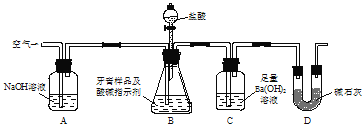
(1)沉淀A的化学式是_________,试剂a的化学式为______________;
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为______________________________________;
(3)Al2O3中所含的化学键的类型为___________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其阳极反应式为______________________________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂。下列氧化物中不能与铝粉组成铝热剂的是(___________)
a MgO b V2O 5 c Fe3O4 d MnO2
【答案】SiO2 NaOH AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或 [Al(OH)4]-+CO2=Al(OH)3↓+HCO3- 离子键 2O2-- 4e- =O2↑ a
【解析】
铝土矿主要成分为Al2O3,还含有SiO2、Fe2O3,铝土矿中加入过量试剂盐酸,Al2O3 、Fe2O3可以溶解,SiO2不溶,所以沉淀A为SiO2;滤液甲中有Al3+、Fe3+和过量的H+,中加入过量NaOH溶液后,Al3+会转化为AlO2-,Fe3+会转化为Fe(OH)3沉淀。过滤后得到滤液乙中含有NaAlO2,再通入过量的CO2,又会得到沉淀C为Al(OH)3,加热后得到Al2O3,再冶炼得到金属Al。
(1)结合上述因为Al2O3 、Fe2O3可以溶解于盐酸,而SiO2不溶与盐酸,所以沉淀A为SiO2;Fe3+和Al3+性质,要除去Fe3+,保留Al3+,应加入NaOH溶液,所以试剂a为NaOH溶液,其化学式为NaOH;所以答案:SiO2, NaOH;
(2)根据上述分析可知滤液乙为NaAlO2,步骤③中通入过量CO2,得到的沉淀C为Al(OH)3,产生沉淀C的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或 [Al(OH)4]-+CO2=Al(OH)3↓+HCO3-;所以答案为;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或 [Al(OH)4]-+CO2=Al(OH)3↓+HCO3-;
(3)Al2O3为离子化合物,所以Al2O3中所含的化学键的类型为离子键;答案:离子键;
(4)工业上电解熔融Al2O3生成金属铝和氧气,其阳极反应式为2O2-- 4e- =O2↑;答案:2O2-- 4e- =O2↑;
(5)铝热反应是利用了铝的还原性,铝能置换出活泼性较铝弱的金属,镁的金属性比铝强,所以铝不能置换出镁,本题正确答案是a。

 阅读快车系列答案
阅读快车系列答案