题目内容
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如图。
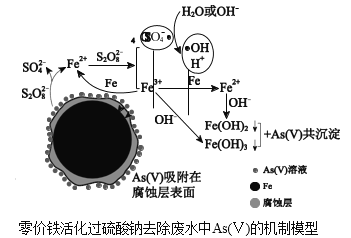
资料:
Ⅰ.酸性条件下SO![]() 为主要的自由基,中性及弱碱性条件下SO
为主要的自由基,中性及弱碱性条件下SO![]() ·和·OH同时存在,强碱性条件下·OH为主要的自由基。
·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
①砷在元素周期表中的位置是_____。
②砷酸的化学式是_____,其酸性比H3PO4_____(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O![]() 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①零价铁与过硫酸钠反应的离子方程式是_____。
②Fe3+转化为Fe2+的离子方程式是_____。
③SO![]() ·和H2O反应的离子方程式是_____。
·和H2O反应的离子方程式是_____。
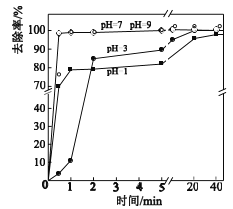
(3)不同pH对As(Ⅴ)去除率的影响如图。5min内pH=7和pH=9时去除率高的原因是_____。
【答案】第4周期、第ⅤA族 H3AsO4 弱 Fe+S2O![]() =Fe2++2SO
=Fe2++2SO![]() Fe+2Fe3+=3Fe2+ SO
Fe+2Fe3+=3Fe2+ SO![]() ·+H2O=·OH+SO
·+H2O=·OH+SO![]() +H+ pH=7和pH=9时,产生了具有强氧化性的SO
+H+ pH=7和pH=9时,产生了具有强氧化性的SO![]() ·和·OH,利于生成Fe2+和Fe3+,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)
·和·OH,利于生成Fe2+和Fe3+,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)
【解析】
(1)①磷元素的原子序数为15,位于元素周期表第3周期ⅤA族,由砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层;
②砷与磷在元素周期表中位于同一主族,同主族元素性质相似,同主族元素,从上到下非金属性依次减弱,最高价氧化物对应水化物的酸性减弱;
(2)①由题意可知,零价铁与过硫酸钠反应生成Fe2+和SO42-;
②Fe3+具有氧化性,Fe与Fe3+发生氧化还原反应生成Fe2+;
③由题给信息可知,SO4—·和H2O反应生成·OH+SO42—;
(3)结合零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型可知,因pH = 7和pH = 9时,产生了具有强氧化性的SO4·和·OH,利于生成Fe2+和Fe3+,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀。
(1)①磷元素的原子序数为15,位于元素周期表第3周期ⅤA族,由砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层可知砷位于元素周期表中第4周期ⅤA族,故答案为:第4周期ⅤA族;
②砷与磷在元素周期表中位于同一主族,同主族元素性质相似,则由磷酸分子式可知,砷酸中砷元素的化合价为+5价,化学式是H3AsO4;同主族元素,从上到下非金属性依次减弱,最高价氧化物对应水化物的酸性减弱,则H3AsO4酸性比H3PO4弱,故答案为:H3AsO4;弱;
(2)①由题意可知,零价铁与过硫酸钠反应生成Fe2+和SO42-,反应的离子方程式为Fe+ S2O82=Fe 2+ +2SO42,故答案为:Fe+ S2O82=Fe 2+ +2SO42;
②Fe3+具有氧化性,Fe与Fe3+发生氧化还原反应生成Fe2+,反应的离子方程式为Fe+ 2Fe 3+=3Fe 2+,故答案为:Fe+ 2Fe 3+=3Fe 2+;
③由题给信息可知,SO4—·和H2O反应生成·OH+SO42—,反应的离子方程式是SO![]() ·+H2O=·OH+SO
·+H2O=·OH+SO![]() +H+,故答案为:SO
+H+,故答案为:SO![]() ·+H2O=·OH+SO
·+H2O=·OH+SO![]() +H+;
+H+;
(3)结合零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型可知,因pH = 7和pH = 9时,产生了具有强氧化性的SO4·和·OH,利于生成Fe2+和Fe3+,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ),则5 min内pH = 7和pH = 9![]() ·和·OH,利于生成Fe2+和Fe3+,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)。
·和·OH,利于生成Fe2+和Fe3+,pH=7和pH=9时,Fe2+和Fe3+形成Fe(OH)2和Fe(OH)3,与As(Ⅴ)发生共沉淀,有效去除As(Ⅴ)。