题目内容
已知:还原性强弱:I- >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |
C
解析本题学生首先要明确:氧化还原反应中还原性强的离子先反应。并抓住氧化还原反应的实质:电子的转移,最后明确计算技巧:电子得失相等。
发生反应:①Cl2 + 2I- = 2Cl- + I2
②Cl2 + 2Fe2+ = 2Cl- + 2Fe3+
设:原溶液的物质的量浓度为:C mol/L
碘化亚铁FeI2共为:0.1C mol
碘离子共:0.1C×2 =" 0.2C" mol
亚铁离子共为:0.1C mol 反应一半则为:0.1C×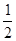 =" 0.05C" mol
=" 0.05C" mol
失去电子共为:0.2C×1+0.05C×1 =" 0.25C" mol
氯气共: =" 0.15" mol 则得到电子共:0.15×2 =" 0.3" mol
=" 0.15" mol 则得到电子共:0.15×2 =" 0.3" mol
得失电子相等:0.3 = 0.25C 解得:C =" 1.2" mol/L
所以:选C

练习册系列答案
相关题目
已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有
的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质的量浓度为( )
| 1 |
| 2 |
| A、1.1mol?L-1 |
| B、1.5mol?L-1 |
| C、1.2mol?L-1 |
| D、1.0mol?L-1 |
已知:还原性强弱:I- >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |