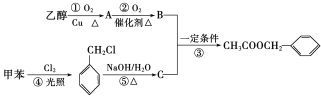
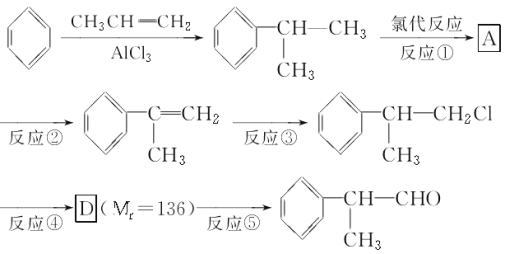
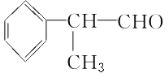题目内容
【题目】已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO45H2O(s) = CuSO4(s)+5H2O(l) △H=+Q2 kJ·mol1则Q1、Q2的关系为
A.Q1<Q2 B.Q1>Q2 C.Q1=Q2 D.无法确定
【答案】A
【解析】
试题分析:根据题的叙述可把胆矾溶于水看成二个过程,第一个过程是:CuSO45H2O![]() CuSO4(s)+5H2O;△H=+Q2KJ/mol这一过程是吸出热量的,一摩尔CuSO4 5H2O分解吸收的热量为Q2KJ;第二过程是:无水硫酸铜制成溶液的过程,此过程是放出热量的,1mol无水硫酸铜制成溶液时放出热量为Q1KJ,但整个过程要使溶液温度降低,说明吸收的热量大于放出的热量,所以Q2>Q1,故选A。
CuSO4(s)+5H2O;△H=+Q2KJ/mol这一过程是吸出热量的,一摩尔CuSO4 5H2O分解吸收的热量为Q2KJ;第二过程是:无水硫酸铜制成溶液的过程,此过程是放出热量的,1mol无水硫酸铜制成溶液时放出热量为Q1KJ,但整个过程要使溶液温度降低,说明吸收的热量大于放出的热量,所以Q2>Q1,故选A。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目