题目内容
4.在强酸性溶液中能大量共存的离子组是( )| A. | Na+、K+、SO32-、Ba2+ | B. | NH4+、Na+、OH-、Cl- | ||
| C. | Al3+、Mg2+、SO42-、Cl- | D. | Fe2+、NO3-、K+、Na+ |
分析 强酸性溶液中含有大量氢离子,离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应且与氢离子不反应的能大量共存,据此分析解答.
解答 解:A.SO32-、Ba2+生成沉淀且亚硫酸根离子和氢离子反应,所以不能大量共存,故A错误;
B.H+、OH-反应生成水而不能大量共存,故B错误;
C.这几种离子之间不反应且和氢离子不反应,所以能大量共存,故C正确;
D.酸性条件下,Fe2+、NO3-发生氧化还原反应而不能大量共存,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,涉及氧化还原反应及复分解反应,易错选项是D.

练习册系列答案
相关题目
5.下列表示物质的化学用语正确的是( )
| A. | 葡萄糖的分子式:C6H12O6 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 14C的原子结构示意图: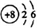 | D. | 氯气的电子式:Cl:Cl |
15.设NA为阿伏加德罗常数的值,下列说法正的是( )
| A. | 高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32- )=1 mol•L-1,则溶液中Na+的个数为2 NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中c(Na+)=2 mol•L-1 |
12.向某无色溶液中加入含Fe2+的溶液无明显变化,当滴加几滴稀H2SO4后,混合液出现红色,下列结论中错误的是( )
| A. | Fe2+被H2S04氧化成Fe3+ | |
| B. | 原无色溶液中一定含有SCN- | |
| C. | Fe2+与SCN-不能形成红色化合物 | |
| D. | 将稀H2SO4换成新制氯水,混合液也会出现红色 |
9.有关合金的性质叙述不正确的是( )
| A. | 合金的熔点比它的各成分的熔点低 | B. | 合金一定是金属熔合而成 | ||
| C. | 合金的硬度和强度一般比纯金属高 | D. | 硬铝、黄铜、钢均为合金 |
16.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | CO2 | NH3 | CaCl2 |
| ③ | HCl | CO2 | 石灰水 |
| ④ | CO2 | SO2 | Ba(NO3)2 |
| ⑤ | NO2 | SO2 | BaCl2 |
| ⑥ | NH3 | CO2 | NaCl |
| A. | ②③④ | B. | ①③④⑤ | C. | ①③④⑤⑥ | D. | ①②③④ |

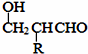 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
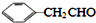 的相对分子质量大2,则符合下列条件的G的同分异构体有3种.
的相对分子质量大2,则符合下列条件的G的同分异构体有3种. 的合成路线
的合成路线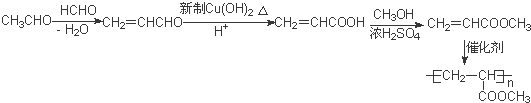 .
.