题目内容
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
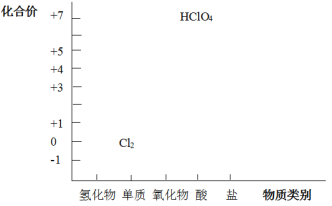
(1)根据图中信息,写出任意一种氯的氧化物的化学式_____。
(2)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的化学方程式_____________。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式_________。
【答案】Cl2O或Cl2O3或Cl2O5或Cl2O7 Zn+2HCl =ZnCl2+ H2 ↑ MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【解析】
⑴根据图中信息,氯的价态有+1,+3,+5,+7,任意一种氯的氧化物的化学式Cl2O或Cl2O3或Cl2O5或Cl2O7。
⑵①化合价降低,表现氧化性,因此体现HCl氧化性的化学方程式是Zn+2HCl =ZnCl2+ H2 ↑等。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,该反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
⑴根据图中信息,氯的价态有+1,+3,+5,+7,任意一种氯的氧化物的化学式Cl2O或Cl2O3或Cl2O5或Cl2O7,故答案为:Cl2O或Cl2O3或Cl2O5或Cl2O7。
⑵①化合价降低,表现氧化性,因此体现HCl氧化性的化学方程式是Zn+2HCl =ZnCl2+ H2 ↑等,故答案为:Zn+2HCl =ZnCl2+ H2 ↑。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,该反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。

【题目】高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸(无水醋酸)中的电离常数:从下表格中判断下列说法不正确的是( )
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.在无水醋酸中1mol/L的高氯酸的电离度约为0.4%
B.在无水醋酸中硝酸是这四种酸中最弱的酸
C.在无水醋酸中,硫酸可以和高氯酸钠反应制备出高氯酸
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱