题目内容
【题目】环扁桃酯又名安脉生,在临床上主要用于治疗脑动脉硬化。环扁桃酯的一种合成路线如下所示:

完成下列填空:
(1)写出反应类型:①_______________ ⑤_______________。
(2)写出反应②的化学方程式。 ___________________
(3)反应⑤中另一反应物F的结构简式为__________________。
(4)检验D是否已经完全转化E的操作是_________________________。
(5)写出一种满足下列条件E的同分异构体的结构简式。________________
i. 能发生水解反应 ii. 苯环上的一溴代物只有两种
(6)苯乙酮( )是工业上合成E的原料之一。设计一条由苯乙酮为原料合成聚苯乙烯(
)是工业上合成E的原料之一。设计一条由苯乙酮为原料合成聚苯乙烯( )的合成路线。(合成路线常用的表示方式为:A
)的合成路线。(合成路线常用的表示方式为:A![]() B
B ![]() )______________________
)______________________
【答案】 取代反应 取代反应 CH2ClCOOH+2NaOH![]() CH2OHCOONa+NaCl+H2O
CH2OHCOONa+NaCl+H2O 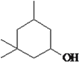 取样,调节样品至碱性,向其中滴加新制Cu(OH)2悬浊液,煮沸,若出现砖红色沉淀说明未完全转化,反之则已完全转化
取样,调节样品至碱性,向其中滴加新制Cu(OH)2悬浊液,煮沸,若出现砖红色沉淀说明未完全转化,反之则已完全转化  等合理即可
等合理即可 
【解析】试题分析:由流程可推断,A是乙酸,A与氯气发生取代反应生成B,B为氯乙酸,B经水解、酸化后生成羟基乙酸,羟基乙酸经催化氧化生成D,D为乙醛酸,D与苯发生加成反应生成E,E为2-羟基-2-苯基乙酸,E与F发生酯化反应(属于取代反应)生成环扁桃酯,则F为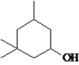 。
。
(1)反应类型:①取代反应;⑤取代反应。
(2)反应②的化学方程式CH2ClCOOH+2NaOH![]() CH2OHCOONa+NaCl+H2O 。
CH2OHCOONa+NaCl+H2O 。
(3)反应⑤中另一反应物F的结构简式为 。
。
(4)D为乙醛酸,检验D是否已经完全转化E,可以检验有机物在是否还有醛基,其操作是:取样,调节样品至碱性,向其中滴加新制Cu(OH)2悬浊液,煮沸,若出现砖红色沉淀说明未完全转化,反之则已完全转化。
(5)E(2-羟基-2-苯基乙酸)的同分异构体满足下列条件:i. 能发生水解反应,说明分子中有酯基; ii. 苯环上的一溴代物只有两种,说明苯环上有两个互为对位的取代基。这样的同分异构体有多种,如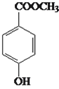 、
、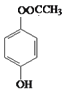 、
、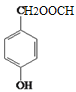 等。
等。
(6)由苯乙酮合成聚苯乙烯(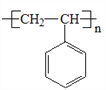 ),可以由苯乙酮催化加氢合成,1-苯乙醇,然后1-苯乙醇发生消去反应得到苯乙烯,最后苯乙烯加聚合成聚苯乙烯。具体合成路线如下:
),可以由苯乙酮催化加氢合成,1-苯乙醇,然后1-苯乙醇发生消去反应得到苯乙烯,最后苯乙烯加聚合成聚苯乙烯。具体合成路线如下: 

 习题精选系列答案
习题精选系列答案【题目】如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: 
(1)p为极,A极发生了反应.
(2)C为极,可收集到;D为极,可收集到 .
(3)C极的电极反应式为 .
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如表:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
阴极产生气体的体积(cm3) | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
阳极产生气体的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是 .
(5)当反应进行一段时间后,A、B电极附近溶液的pH(填“增大”“减小”或“不变”).
(6)当电路中通过0.004mol电子时,B极上沉积的金属X为0.128g,则此金属的摩尔质量为 .
【题目】电解质的水溶液中存在电离平衡.
(1)醋酸是常见的弱酸. ①醋酸在水溶液中的电离方程式为 .
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是(填字母序号).
A.滴加少量浓盐酸 B.微热溶液
C.加水稀释 D.加入少量醋酸钠晶体
(2)用0.1molL﹣1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1molL﹣1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线. 
①滴定醋酸的曲线是(填“I”或“Ⅱ”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是 .
③V1和V2的关系:V1V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 .
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验. 资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
操作步骤 | 现象 |
步骤1:向2mL 0.005molL﹣1 AgNO3溶液中加入2mL 0.005molL﹣1 KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴2molL﹣1 Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3molL﹣1 AgNO3溶液 | 现象a﹍﹍﹍,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3molL﹣1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式 .
②步骤3中现象a是 .
③用化学平衡原理解释步骤4的实验现象 .

