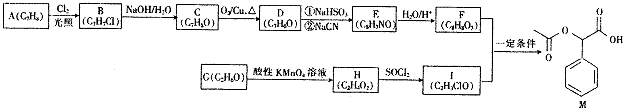
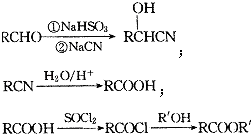题目内容
【题目】合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.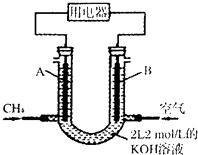
(1)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积0<V<44.8L时,负极电极反应为;
(2)若以该燃料电池作为电源,用石墨作电极电解500mL 饱和食盐水,当两极共收集到标准状况下的气体1.12L(以不考虑气体的溶解)时,所得溶液的pH=(假设反应前后溶液体积不变).
【答案】
(1)CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O
+7H2O
(2)13
【解析】解:(1)甲烷燃料碱性电池中,负极上甲烷失电子和KOH反应生成碳酸钾和水,则负极电极反应式为CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O,所以答案是:CH4﹣8e﹣+10OH﹣=CO
+7H2O,所以答案是:CH4﹣8e﹣+10OH﹣=CO ![]() +7H2O;(2)用石墨电解饱和食盐水时电池反应式为2NaCl+2H2O
+7H2O;(2)用石墨电解饱和食盐水时电池反应式为2NaCl+2H2O ![]() H2↑+Cl2↑+2NaOH,如果两个电极上共收集到标况下的1.12L气体,则每个电极上得到气体物质的量=
H2↑+Cl2↑+2NaOH,如果两个电极上共收集到标况下的1.12L气体,则每个电极上得到气体物质的量= ![]() =0.025mol,根据氢气和NaOH之间的关系式得n(NaOH)=2n(H2)=2×0.025mol=0.05mol,c(NaOH)=
=0.025mol,根据氢气和NaOH之间的关系式得n(NaOH)=2n(H2)=2×0.025mol=0.05mol,c(NaOH)= ![]() =0.1mol/L,溶液中c(H+)=
=0.1mol/L,溶液中c(H+)= ![]() mol/L=10﹣13 mol/L,pH=﹣lgc(H+)=﹣lg10﹣13=13, 所以答案是:13.
mol/L=10﹣13 mol/L,pH=﹣lgc(H+)=﹣lg10﹣13=13, 所以答案是:13.

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案【题目】表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
A | B | ||||||
D | E | F | |||||
C | G | H |
(1)上述元素的单质中熔点最高的可能是________________(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是__________________________________________________________。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为___________;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中第__________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___________(填字母代号)元素组成的,用化学方程式表示吸收原理_________________________________________________________________。
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______________。