题目内容
【题目】M是一种重要的医药中间体,其合成路线如图: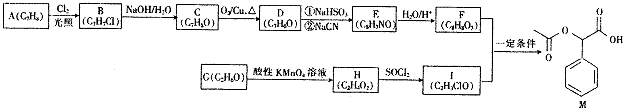
已知: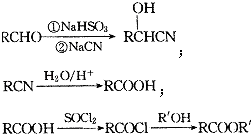 ;
;
回答下列问题:
(1)A的名称是 , F中所含官能团的名称是;
(2)C→D的反应类型为 , H→I的反应类型为;
(3)E的结构简式为;
(4)F+I→M的化学方程式为
(5)F的同分异构体中,符合下列条件的共有种.①能与FeCl3溶液发生显色反应
②能发生水解反应
③苯环上只有两个取代基
其中核磁共振氢谱显示有5组峰,且峰面积之比为1:1:2:2:2的是(填结构简式).
【答案】
(1)甲苯;羟基、羧基
(2)氧化反应;取代反应
(3)
(4)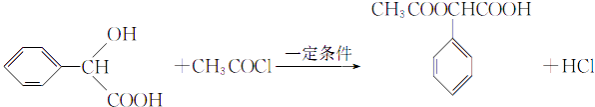
(5)9;![]()
【解析】解:根据流程图,A中应该含有苯环,A为 ![]() ,在光照时侧链与氯气发生取代反应,B为
,在光照时侧链与氯气发生取代反应,B为 ![]() ;B在氢氧化钠溶液中水解生成C,则C为
;B在氢氧化钠溶液中水解生成C,则C为 ![]() ,C氧化生成D为
,C氧化生成D为 ![]() ;根据已知信息,E为
;根据已知信息,E为 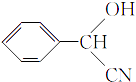 ,F为
,F为 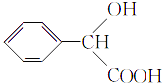 ,G为乙醇(CH3CH2OH),H为乙酸(CH3COOH),根据信息知,I为CH3COCl,F和I在一定条件下 反应生成M(
,G为乙醇(CH3CH2OH),H为乙酸(CH3COOH),根据信息知,I为CH3COCl,F和I在一定条件下 反应生成M( 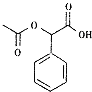 ).(1)根据上述分析,A为甲苯,F为
).(1)根据上述分析,A为甲苯,F为  ,所含官能团是羟基和羧基,所以答案是:甲苯;羟基、羧基;(2)C为苯甲醇,C氧化生成D(苯甲醛);H为乙酸(CH3COOH),根据信息知,H与二氯亚砜发生取代反应生成I(CH3COCl), 所以答案是:氧化反应;取代反应;(3)根据上述分析,E为
,所含官能团是羟基和羧基,所以答案是:甲苯;羟基、羧基;(2)C为苯甲醇,C氧化生成D(苯甲醛);H为乙酸(CH3COOH),根据信息知,H与二氯亚砜发生取代反应生成I(CH3COCl), 所以答案是:氧化反应;取代反应;(3)根据上述分析,E为  ,所以答案是:
,所以答案是: 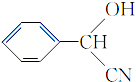 ;(4)根据信息,F和I在一定条件下发生取代反应生成M,反应的化学方程式为
;(4)根据信息,F和I在一定条件下发生取代反应生成M,反应的化学方程式为 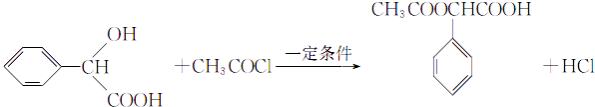 ,所以答案是:
,所以答案是: 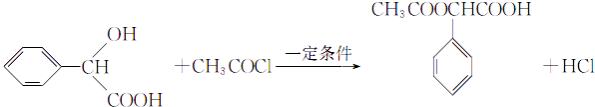 ;(5)F为
;(5)F为 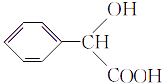 ,其同分异构体满足:①能与FeCl3溶液发生显色反应,表明分子结构中存在酚羟基;②能发生水解反应,表明分子结构中含有酯基;③苯环上只有两个取代基,符合上述条件的F的同分异构体的结构简式有:
,其同分异构体满足:①能与FeCl3溶液发生显色反应,表明分子结构中存在酚羟基;②能发生水解反应,表明分子结构中含有酯基;③苯环上只有两个取代基,符合上述条件的F的同分异构体的结构简式有: ![]() (包括邻位、间位和对位3种);
(包括邻位、间位和对位3种); ![]() (包括邻位、间位和对位3种);
(包括邻位、间位和对位3种); ![]() (包括邻位、间位和对位3种),共9种,其中核磁共振氢谱显示有5组峰,且峰面积之比为1:1:2:2:2的是
(包括邻位、间位和对位3种),共9种,其中核磁共振氢谱显示有5组峰,且峰面积之比为1:1:2:2:2的是 ![]() ,
,
所以答案是:9; ![]() .
.

【题目】如表是某指示剂在一定pH范围内所显示的颜色:向滴有少量该指示剂的稀硫酸中,加入氢氧化钠溶液,出现的颜色变化可能是( )
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
PH范围 | 1~3 | 4~5 | 6~7 | 8~11 | 11~14 |
A.由红变紫
B.由蓝变绿
C.由绿变橙
D.由蓝变紫