题目内容
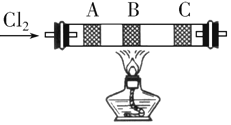
【题目】某同学设计如图装置,研究非金属元素性质变化规律.
(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.在化学反应中,一般地,强酸能制弱酸,如NaHCO3+HCl═NaCl+CO2↑+H2O,得出:HCl酸性强于H2CO3的酸性.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:
(1)酸性:HNO3>H2CO3>H2SiO3
A、B、C中装试剂分别为_______;C中实验现象为______________________;
写出C中发生反应的离子方程式____________________________.
(2)已知高锰酸钾在常温下与浓盐酸反应产生氯气,利用如图装置证明氯气氧化性强于碘单质的氧化性.则A中装浓盐酸,B中装入高锰酸钾粉末,C中装试剂_______,C中现象_______________,写出B中反应的离子方程式___________________________.
(3)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,写出化学方程式______;证明氯的非金属性比硫的非金属性______(填“强”或“弱”或“无法判断”)。
【答案】 HNO3、CaCO3、Na2SiO3 有白色沉淀生成 SiO32-+CO2+H2O=H2SiO3↓+CO32- 淀粉KI溶液 溶液变成蓝色 2MnO4-+10Cl-+16H+=2Mn2++5Cl2+8H2O Cl2+H2S=2HCl+S↓ 强
【解析】(1)要证明酸性:HNO3>H2CO3>H2SiO3,应该先加入硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸白色沉淀;因此装置C中反应是:SiO32-+CO2+H2O=H2SiO3↓+CO32-;(2)利用如图装置证明氯气氧化性强于碘单质的氧化性,C中发生的是氯气和碘离子的反应生成碘单质,碘单质遇淀粉变蓝,所以C中加入淀粉碘化钾;B中产生氯气,反应的方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2+8H2O;(3)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,二者反应产生氯气,氯气氧化H2S生成单质硫,说明氯元素非金属性强于硫,因此反应开始后观察现象是C中产生淡黄色沉淀,反应的化学方程式为:Cl2+H2S=S↓+2HCl。

【题目】如表是某指示剂在一定pH范围内所显示的颜色:向滴有少量该指示剂的稀硫酸中,加入氢氧化钠溶液,出现的颜色变化可能是( )
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
PH范围 | 1~3 | 4~5 | 6~7 | 8~11 | 11~14 |
A.由红变紫
B.由蓝变绿
C.由绿变橙
D.由蓝变紫