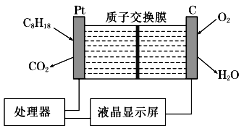
题目内容
【题目】盖斯定律指出:化学反应的反应热只与反应的始态和终态有关,而与具体反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列错误的是
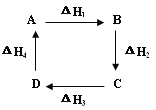
A.ΔH1+ΔH2+ΔH3+ΔH4=1
B.A→D,ΔH=-ΔH4
C.ΔH1+ΔH2 =-ΔH3-ΔH4
D.B→D ,ΔH=ΔH2+ΔH3
【答案】A
【解析】
A. 根据盖斯定律及图示知,物质A经过一系列转化最终又得到物质A,所以初始状态相同,反应热为0,则ΔH1+ΔH2+ΔH3+ΔH4=0,故A错误;
B. A→D与D→A互为逆反应,则根据盖斯定律得,ΔH=-ΔH4,故B正确;
C. ΔH1+ΔH2 表示A→C的反应热,C→A的反应热为ΔH3+ΔH4,则ΔH1+ΔH2 =-ΔH3-ΔH4,故C正确;
D.如图所示B →D ,ΔH=ΔH2+ΔH3,故D正确;
故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)