题目内容
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则
- A.原子半径:乙>丁>丙
- B.非金属性:丙>丁>戊
- C.甲与戊形成的化合物是共价化合物
- D.乙、丙、丁最高价氧化物对应的水化物均是强酸
C
试题分析:短周期主族元素原子半径最小是氢,NH3的水溶液呈碱性,N、P均位于第VA族,单质硅可制成半导体材料,氯元素的最高正价为+7价,由此推断可知五种元素分别为氢、氮、硅、磷、氯。A项,乙、丙、丁分别为氮、硅、磷,根据元素周期律可知,原子半径:Si>P>N,故A选项错误;B项,丙、丁、戊分别为硅、磷、氯,由元素周期律可知,非金属性:Si<P<Cl,故B选项错误;C项,甲、戊分别是氢、氯,都是非金属元素,两种原子最外层电子数分别为1、7,分别需要共用1对电子形成稳定电子层结构,因此它们形成的HCl是共价化合物,故C选项正确;D项,乙、丙、丁分别为氮、硅、磷,它们的最高价氧化物对应水化物分别是硝酸、硅酸和磷酸,只有硝酸是强酸,硅酸是弱酸,磷酸是中强酸,故D选项错误。
考点:考查物质结构和元素周期律,涉及元素在周期表的位置、物质结构、元素及其化合物的主要性质之间的综合推断等。
试题分析:短周期主族元素原子半径最小是氢,NH3的水溶液呈碱性,N、P均位于第VA族,单质硅可制成半导体材料,氯元素的最高正价为+7价,由此推断可知五种元素分别为氢、氮、硅、磷、氯。A项,乙、丙、丁分别为氮、硅、磷,根据元素周期律可知,原子半径:Si>P>N,故A选项错误;B项,丙、丁、戊分别为硅、磷、氯,由元素周期律可知,非金属性:Si<P<Cl,故B选项错误;C项,甲、戊分别是氢、氯,都是非金属元素,两种原子最外层电子数分别为1、7,分别需要共用1对电子形成稳定电子层结构,因此它们形成的HCl是共价化合物,故C选项正确;D项,乙、丙、丁分别为氮、硅、磷,它们的最高价氧化物对应水化物分别是硝酸、硅酸和磷酸,只有硝酸是强酸,硅酸是弱酸,磷酸是中强酸,故D选项错误。
考点:考查物质结构和元素周期律,涉及元素在周期表的位置、物质结构、元素及其化合物的主要性质之间的综合推断等。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,它们的部分化合价如下表,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 最高正价或最低负价 | -4 | +1 | +4 | -2 | -1 |
| A、乙的单质中能与水剧烈反应 |
| B、气态氢化物的稳定性:丙>甲 |
| C、丙的氧化物能与戊的氢化物水溶液反应 |
| D、其最高价氧化物对应的水化物的酸性:丁>戊 |
短周期元素甲、乙、丙、丁在元素周期表的相对位置如表所示,其中甲的气态氢化物的水溶液呈碱性,则下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 |
| A、甲位于元素周期表中第2周期、第ⅤA族 |
| B、原子半径:甲>乙 |
| C、单质的氧化性:丙>乙 |
| D、气态氢化物稳定性:丁>丙>乙 |
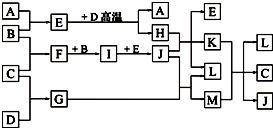 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).