题目内容
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原于内质子数之比为1:2,X2+和Z-离子的电子数之差为8。下列说法不正确的是
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原于半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
D
试题分析:X2+和Z-离子的电子数之差为8。这说明二者分别是第ⅡA元素和第ⅦA元素,分别是应该是Mg和Cl。W和X元素原于内质子数之比为1:2,所以W是C元素。又因为四种原子的最外层电子数之和为19,所以Y是Si。所以选项D不正确,应该是HClO4,其余选项都是正确的,答案选D。
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力

练习册系列答案
相关题目
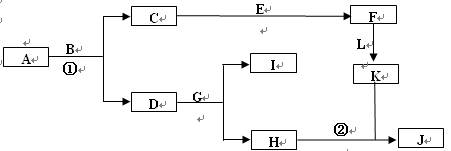
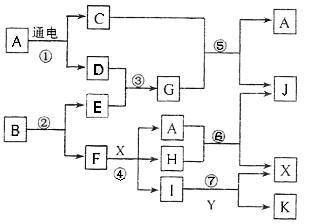
 请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。
请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。