题目内容
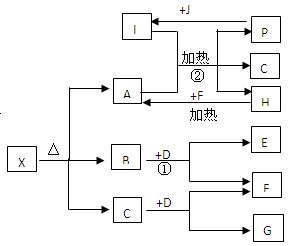
(14分)一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体。
(1)若A、C、D均含氯元素,C为氯碱工业的原料,
D溶液具有漂白性,则A与B反应的化学方程式是 ;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是 ;过量B溶液与NH4HCO3溶液共热,生成气体G的离子方程式是 ,G遇硝酸蒸气的现象是 。
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体。A与B反应的化学是 ;a molA与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是 。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的实验方法是 。

(1)若A、C、D均含氯元素,C为氯碱工业的原料,
D溶液具有漂白性,则A与B反应的化学方程式是 ;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是 ;过量B溶液与NH4HCO3溶液共热,生成气体G的离子方程式是 ,G遇硝酸蒸气的现象是 。
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体。A与B反应的化学是 ;a molA与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是 。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的实验方法是 。
(14分,每空2分)(1) Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-);
NH4++HCO3-+2OH- = -CO32-+NH3↑+2 H2O;产生白烟 。
(2)Cu+2H2SO4(浓)(14分,每空2分)(1) Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-);
NH4++HCO3-+2OH- = -CO32-+NH3↑+2 H2O;产生白烟 。
(2)Cu+2H2SO4(浓)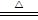 CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
(3)取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色(合理答案均得分)。 CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
(3)取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色(合理答案均得分)。
NH4++HCO3-+2OH- = -CO32-+NH3↑+2 H2O;产生白烟 。
(2)Cu+2H2SO4(浓)(14分,每空2分)(1) Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-);
NH4++HCO3-+2OH- = -CO32-+NH3↑+2 H2O;产生白烟 。
(2)Cu+2H2SO4(浓)
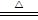 CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;(3)取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色(合理答案均得分)。 CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
(3)取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色(合理答案均得分)。
略

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目

 ,第________族;
,第________族; ) 写出铜与稀HBO3溶液反应的离子反应方程式
) 写出铜与稀HBO3溶液反应的离子反应方程式