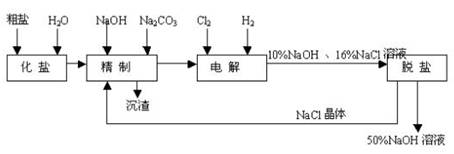
题目内容
完成下列离子反应方程式
(1)硫酸与氢氧化钡溶液反应
(2)MnO2和浓盐酸反应制Cl2
(3)铝和氢氧化钠溶液反应
(4)醋酸与苛性钠反应
(5)往氯化亚铁溶液中通入氯气(足量)
(6)氢氧化铝溶于稀盐酸
(1)硫酸与氢氧化钡溶液反应
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
(2)MnO2和浓盐酸反应制Cl2
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
(3)铝和氢氧化钠溶液反应
2Al+2H2O+2OH-=2AlO2-+3H2↑
2Al+2H2O+2OH-=2AlO2-+3H2↑
(4)醋酸与苛性钠反应
CH3COOH+OH-=CH3COO-+H2O
CH3COOH+OH-=CH3COO-+H2O
(5)往氯化亚铁溶液中通入氯气(足量)
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
(6)氢氧化铝溶于稀盐酸
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
.分析:(1)反应生成硫酸钡和水;
(2)反应生成氯化锰、氯气、水;
(3)反应生成偏铝酸钠和氢气;
(4)反应生成醋酸钠和水;
(5)反应生成氯化铁;
(6)反应生成氯化铝和水;
结合沉淀、气体、水、弱电解质、单质、金属氧化物等在离子反应中保留化学式等来解答.
(2)反应生成氯化锰、氯气、水;
(3)反应生成偏铝酸钠和氢气;
(4)反应生成醋酸钠和水;
(5)反应生成氯化铁;
(6)反应生成氯化铝和水;
结合沉淀、气体、水、弱电解质、单质、金属氧化物等在离子反应中保留化学式等来解答.
解答:解:(1)反应生成硫酸钡和水,离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(2)反应生成氯化锰、氯气、水,离子反应为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(3)反应生成偏铝酸钠和氢气,则离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(4)反应生成醋酸钠和水,离子反应为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
(5)反应生成氯化铁,离子反应为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(6)反应生成氯化铝和水,离子反应为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O.
(2)反应生成氯化锰、氯气、水,离子反应为MnO2+4H++2Cl-
| ||
| ||
(3)反应生成偏铝酸钠和氢气,则离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(4)反应生成醋酸钠和水,离子反应为CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
(5)反应生成氯化铁,离子反应为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(6)反应生成氯化铝和水,离子反应为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O.
点评:本题考查离子反应方程式的书写,明确物质之间反应的量的关系为解答的关键,注意离子反应的书写方法及沉淀、气体、水等保留化学式,题目难度不大.

练习册系列答案
相关题目
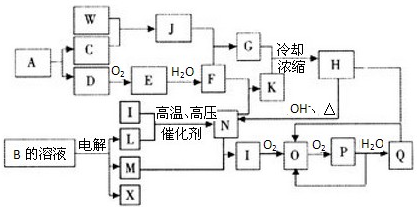
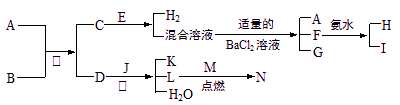 A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系
A到N为中学化学常见物质或该物质的水溶液,且它们之间存在如下转化关系