题目内容
请回答下列问题:
(1)实验室中贮存物质Q的方法是将其盛放在
(2)化合物N的电子式为
(3)已知60g A生成C、D放出426.5kJ的热量,请写出表示其燃烧热的热化学方程式为:
(4)完成下列问题:①M和N发生置换反应生成I的化学方程式为:
(1)Q为HNO3,易挥发、见光易分解,实验室需要放在棕色试剂瓶中,H在Q的稀溶液中反应生成O的离子方程为3Fe2++NO3-+4H+=3Fe3++NO+2H2O,
故答案为:带玻璃瓶塞的棕色细口瓶;3Fe2++NO3-+4H+=3Fe3++NO+2H2O;
(2)化合物N为NH3,电子式为
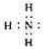 ,P为NO2,加压时反应2NO2?N2O4向正反应方向移动,气体颜色先变深后变浅,达到平衡后比原来颜色深,
,P为NO2,加压时反应2NO2?N2O4向正反应方向移动,气体颜色先变深后变浅,达到平衡后比原来颜色深,故答案为:
 ;气体颜色先变深后变浅,达到平衡后比原来颜色深;
;气体颜色先变深后变浅,达到平衡后比原来颜色深;(3)A为FeS2,n(FeS2)=0.5mol,放出426.5kJ的热量,则1molFeS2放出853kJ热量,表示其燃烧热的热化学方程式为FeS2(s)+
| 11 |
| 4 |
| 1 |
| 2 |
故答案为:FeS2(s)+
| 11 |
| 4 |
| 1 |
| 2 |
(4)I为N2,N为NH3,M为Cl2,M和N发生置换反应生成I的化学方程式为3Cl2+2NH3=N2+6HCl,C、D在F的稀溶液中也能生成G,其离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,
故答案为:3Cl2+2NH3=N2+6HCl;Fe2O3+SO2+2H+=2Fe2++SO42-+H2O.

合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
|
|
甲 |
乙 |
丙 |
|
反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
|
达到平衡的时间/min |
|
5 |
8 |
|
平衡时N2的浓度/mol·L-1 |
c1 |
1.5 |
|
|
NH3的体积分数 |
ω1 |
|
ω3 |
|
混合气体密度/g·L-1 |
ρ1 |
ρ2 |
|
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4 (l) (氨基甲酸铵)
△H1
H2NCOONH4 (l) (氨基甲酸铵)
△H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)
△H2
H2O(l)+H2NCONH2(l)
△H2
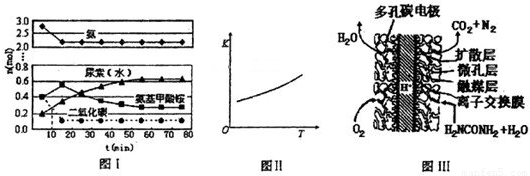
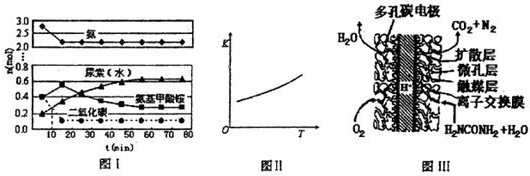
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H =a kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2=bkJ· kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = c kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。

 H2O(l)+H2NCONH2(l)
△H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l)
△H=-103.7 kJ·mol-1
 容器
容器