题目内容
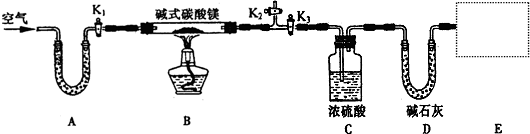
(13分)(1)下图所示是实验室中制取气体的一种简易装置。
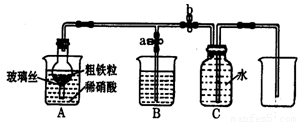
① 甲同学用下列方法检验装置的气密性,请问能否达到目的 (填能或否)
关闭止水夹a和b,从A处烧杯中加入水,使干燥管与烧杯中液面形成液面差,一段时间后,液面差没有变化,说明气密性良好。
②实验室利用上图所示发生装置可以制取下列 气体。
A.Cl2 B.CO2 C.H2S D.SO2
(2)乙同学利用该图所示装置,用粗铁粒与3mol·L-1硝酸反应制取NO气体。请回答有关问题。
①NO气体能用排水法收集,而不能用排空气法收集的可能原因是 。
②制取NO时,向A杯中加入稀硝酸,同时打开止水夹a,关闭止水夹b,A装置的干燥管中观察到气体的颜色的变化为 。B装置烧杯中液体的作用是 。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
③将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量为 mol(用含b的代数式表示)。
【答案】
(13分、每空2分)
(1) ①能
②B C
(2) ①NO与空气中的O2反应;NO与空气密度接近
②红棕色 吸收NOx
③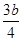 mol( 3分)
mol( 3分)
【解析】

练习册系列答案
相关题目
 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).