题目内容
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:

I.图一中A为教材制备乙酸乙酯的实验装置,甲同学认为图一中B装置比A要好,则冷却水应从______口进入;乙同学认为图一中C装置效果更好,理由是_______。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)26H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)[提出猜想]小组同学认为分解产物可能有以下几种情况:
A.Fe2O3、SO2、NH3、H2O B.FeO、SO3、NH3、H2O
C.FeO、SO2、NH3、H2O D.Fe2O3、SO3、SO2、NH3、H2O
根据所学知识,可确定_________不成立(填序号)
(2)[药品验纯]甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和_________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加_______(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)[实验探究]为检验分解产物,甲同学设计了如下实验装置。
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为________。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______。
(4)[实验结论与反思]通过实验现象和认真反思,上述猜想中一定正确的是______。(填序号)
【答案】b 既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成 C Ba(OH)2 硫氰化钾溶液,溶液不变红色 使分解产生的气体在B、C中被吸收充分 SO2+H2O2+Ba2+=BaSO4↓+2H+ FeO A
【解析】
I.为充分冷凝蒸气,冷却水的流向和蒸气的流向应该相反,所以冷却水应从b口进入;C装置既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成。故答案为b,既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成。
Ⅱ.(1)A. “摩尔盐”中铁的化合价为+2价,硫为+6价,生成物中铁为+3价,硫为+4价,化合价既有升高又有降低,所以A合理;
B.没有任何一种元素的化合价发生变化,所以B合理;
C.只有硫的化合价降低,不符合氧化还原反应的要求,所以C不合理;
D.铁的化合价升高,硫的化合价部分降低,所以D合理。
所以选C。
(2)“摩尔盐”中含有NH4+,可以加入强碱溶液,加热,用湿润的红色石蕊试纸检验逸出的氨气。加入强碱溶液后,Fe2+可以和OH-生成Fe(OH)2白色沉淀,白色沉淀会迅速变成灰绿色,最后变成红褐色的Fe(OH)3,可以据此检验Fe2+。SO42-可以用稀盐酸和Ba2+检验,产生不溶于盐酸的白色沉淀BaSO4,所以选择既可以提供OH-又能提供Ba2+的Ba(OH)2溶液;若“摩尔盐”因氧化而变质,则会存在Fe3+,可以用KSCN溶液检验。故答案为Ba(OH)2,硫氰化钾溶液,溶液不变红色。
(3)①“摩尔盐”加热分解完全后打开K,再通入N2,目的是使分解产生的气体在B、C中被吸收充分。
②实验中观察到C中产生白色沉淀,原因是SO2通入C中,被H2O2氧化为SO42-,SO42-和Ba2+生成了BaSO4。则C中发生反应的离子方程式为SO2+H2O2+Ba2+=BaSO4↓+2H+。
③A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,若产物中有FeO,则溶于稀硫酸后生成的Fe2+能使KMnO4稀溶液褪色,KMnO4稀溶液不褪色证明产物不含FeO。
(4)实验中观察到A中固体逐渐变为红棕色,所以“摩尔盐”分解产生了Fe2O3,B中产生白色沉淀,可能是生成了SO3,进入水溶液中后和水反应生成了H2SO4,H2SO4和BaCl2反应生成了BaSO4,也可能是氨气和SO2一起进入B中,氨和SO2生成的(NH4)2SO3和BaCl2反应生成了BaSO3。C中产生白色沉淀,是SO2通入C中,被H2O2氧化为SO42-,SO42-和Ba2+生成了BaSO4。所以一定有SO2和Fe2O3生成。则上述猜想中一定正确的是A。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】为探究![]() 、
、![]() 与盐酸(浓度为
与盐酸(浓度为![]() )反应过程中的热效应,实验测得的数据如表所示:
)反应过程中的热效应,实验测得的数据如表所示:
序号 | 35mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5g | 20.0 | 18.5 |
② | 水 | 3.2g | 20.0 | 24.3 |
③ | 盐酸 | 2.5g | 20.0 | 16.2 |
④ | 盐酸 | 3.2g | 20.0 | 25.1 |
由此得出的结论正确的是( )
A.![]() 固体与盐酸的反应是吸热反应
固体与盐酸的反应是吸热反应
B.![]() 固体与盐酸的反应是放热反应
固体与盐酸的反应是放热反应
C.20.0℃时,含3.2g![]() 的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g![]() 的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
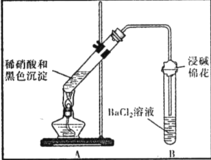
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为______________。
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是______________。
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明黑色沉淀具有_________性。 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:__________。
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全,则混合物中Cu2S 的质量分数为____________________。