题目内容
关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3- 对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
①上述反应中的氧化剂为 。
②上述反应中若生成标况下3.36LN2,则转移的电子数为 。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上制取氯气的化学反应方程式为 。
②漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应的离子方程式为 。
① NaNO3 ② 1.5NA或9.03 ×1023③2NaCl+2 H2O=Cl2 ↑+H2 ↑+2NaOH
④ Ca2++2 ClO-+CO2+H2O=CaCO3↓+2 HClO
【解析】
试题分析:(1)①反应物中NaNO3到产物中N2,N的价态由+5价变为0价。化合价降低,做氧
化剂。②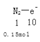 可以求出电子数为1.5NA
可以求出电子数为1.5NA
(2)①2NaCl+2 H2O=Cl2 ↑+H2 ↑+2NaOH
②Ca2++2 ClO-+CO2+H2O=CaCO3↓+2 HclO
考点:考察氧化还原反应中的基本知识和电子的转移数的运算。
