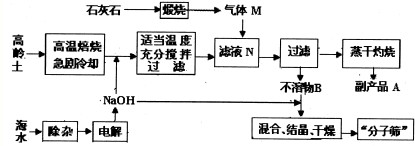
题目内容
已知200mlH2SO4溶液中H+的浓度为1mol/L,
(1)若在此溶液中加入1mol/L的NaOH至恰好呈中性需NaOH的体积为
(2)若在此溶液中加入1mol/L的Ba(OH)2至恰好呈中性,生成沉淀的质量为
(3)若将此溶液加入到足量的碳酸钡中,则此反应的离子方程式为
(1)若在此溶液中加入1mol/L的NaOH至恰好呈中性需NaOH的体积为
200
200
ml,(2)若在此溶液中加入1mol/L的Ba(OH)2至恰好呈中性,生成沉淀的质量为
23.3
23.3
g,则此反应的离子方程式为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
.(3)若将此溶液加入到足量的碳酸钡中,则此反应的离子方程式为
BaCO3+2H++SO42-═BaSO4↓+H2O+CO2↑
BaCO3+2H++SO42-═BaSO4↓+H2O+CO2↑
,生成气体在标况下的体积为2240
2240
ml.分析:(1)恰好呈中性,n(H+)=n(0H-);
(2)恰好呈中性,反应生成硫酸钡和水;
(3)硫酸与碳酸钡反应生成硫酸钡、水、二氧化碳,以此计算生成的二氧化碳.
(2)恰好呈中性,反应生成硫酸钡和水;
(3)硫酸与碳酸钡反应生成硫酸钡、水、二氧化碳,以此计算生成的二氧化碳.
解答:解:(1)恰好呈中性,n(H+)=n(0H-),则0.2L×1mol/L=V×0.1mol/L,解得V=2L,即为200mL,故答案为:200;
(2)恰好呈中性,反应生成硫酸钡和水,反应为Ba(OH)2+H2SO4═BaSO4↓+2H2O,生成硫酸钡为0.2L×0.5mol/L×233g/mol=23.3g,离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故答案为:23.3;Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(3)硫酸与碳酸钡反应生成硫酸钡、水、二氧化碳,离子反应为BaCO3+2H++SO42-═BaSO4↓+H2O+CO2↑,则生成的二氧化碳为0.2L×0.5mol/L×22.4L/mol=2.24L,即为2240mL,故答案为:BaCO3+2H++SO42-═BaSO4↓+H2O+CO2↑;2240.
(2)恰好呈中性,反应生成硫酸钡和水,反应为Ba(OH)2+H2SO4═BaSO4↓+2H2O,生成硫酸钡为0.2L×0.5mol/L×233g/mol=23.3g,离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故答案为:23.3;Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O;
(3)硫酸与碳酸钡反应生成硫酸钡、水、二氧化碳,离子反应为BaCO3+2H++SO42-═BaSO4↓+H2O+CO2↑,则生成的二氧化碳为0.2L×0.5mol/L×22.4L/mol=2.24L,即为2240mL,故答案为:BaCO3+2H++SO42-═BaSO4↓+H2O+CO2↑;2240.
点评:本题考查离子反应方程式的书写及计算,明确离子反应的书写方法及浓度与物质的量的计算即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目




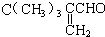
 到
到 的合成路线(用流程图表示,并注明反应条件)
的合成路线(用流程图表示,并注明反应条件)