题目内容
已知2SO2(g)+O2(g )?2SO3(g)(正反应放热),若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
分析:A、根据降低温度,反应速率减慢;
B、根据催化剂可以加快反应速率;
C、根据可逆反应不可能完全进行到底;
D、根据平衡状态时的标志来判断;
B、根据催化剂可以加快反应速率;
C、根据可逆反应不可能完全进行到底;
D、根据平衡状态时的标志来判断;
解答:解:A、因降低温度,反应速率减慢,故A错误;
B、因催化剂可以加快反应速率,故B正确;
C、因可逆反应不可能完全进行到底,所以SO2不能完全转化为SO3,故C错误;
D、因平衡状态时SO2和SO3的浓度不变,而不是相等,故D错误;
故选:B.
B、因催化剂可以加快反应速率,故B正确;
C、因可逆反应不可能完全进行到底,所以SO2不能完全转化为SO3,故C错误;
D、因平衡状态时SO2和SO3的浓度不变,而不是相等,故D错误;
故选:B.
点评:本题主要考查了影响化学反应速率的因素以及化学平衡的判断,难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
已知2SO2(g)+O2(g)═2SO3(g),△H=-197.8kJ?mol-1,则反应:SO3 (g)═
O2 (g)+SO2 (g)的△H是( )
| 1 |
| 2 |
| A、+197.8kJ?mol-1 |
| B、+98.9kJ?mol-1 |
| C、-296.7kJ?mol-1 |
| D、-98.9kJ?mol-1 |
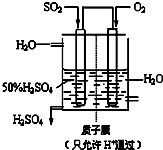
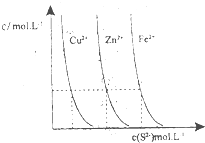 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题: