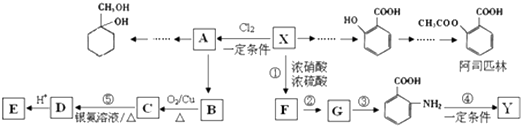
题目内容
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=﹣12.1kJmol﹣1;HCl(aq)与NaOH(aq)中和反应的△H=﹣55.6kJmol﹣1 . 则HCN在水溶液中电离的△H等于( )
A.+43.5kJmol﹣1
B.﹣43.5kJmol﹣1
C.﹣67.7kJmol﹣1
D.+67.7kJmol﹣1
【答案】A
【解析】解:反应的热化学方程式分别为:HCN(aq)+OH﹣(aq)═CN﹣(aq)+H2O(l)△H=﹣12.1kJmol﹣1…①
H+(aq)+OH﹣(aq)═H2O(l)△H=﹣55.6kJmol﹣1…②
HCN电离方程式为,HCN ![]() H++CN﹣ , 用①﹣②可得HCN电离的热化学方程式为:
H++CN﹣ , 用①﹣②可得HCN电离的热化学方程式为:
HCN(aq) ![]() H+(aq)+CN﹣(aq)△H=﹣12.1kJmol﹣1﹣(﹣55.6kJmol﹣1)=+43.5kJmol﹣1 ,
H+(aq)+CN﹣(aq)△H=﹣12.1kJmol﹣1﹣(﹣55.6kJmol﹣1)=+43.5kJmol﹣1 ,
故选A.
利用盖斯定律进行计算,分别写出两个反应的热化学方程式,将两个热化学方程式相加(减)得到HCN在水溶液中电离的电离方程式,同时反应热也随之相加(减),可得HCN在水溶液中电离的反应热.

练习册系列答案
相关题目