题目内容
11.某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:①NH4+(aq)+$\frac{3}{2}$O2(g)═NO2-(aq)+2H+(aq)+HO2(l)
②NO2-(aq)+$\frac{1}{2}$O2(g)═NO3-(aq)
下列说法正确的是( )
| A. | 1mol的NH3和1mol的NH4+都有10×6.02×1023个质子 | |
| B. | 室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)<Kb(NH3•H2O) | |
| C. | NH4+(aq)+2O2(g)═NO3-(aq)+2H+(aq)+H2O(l);△H=-346kJ/mol | |
| D. | 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
分析 A、1mol的NH3含有10mol质子,1mol 的NH4+含有11mol质子;
B、NH4NO2溶液呈酸性,说明铵根离子的水解程度大于NO2-的水解程度;
C、依据热化学方程式和盖斯定律计算得到;
D、依据反应过程分析可知,①中生成氢离子,酸性增强.
解答 解:A、1mol的NH3含有10mol质子,1mol 的NH4+含有11mol质子,即分别为10×6.02×1023、11×6.02×1023个质子,故A错误;
B、NH4NO2溶液呈酸性,说明铵根离子的水解程度大于NO2-的水解程度,根据越弱越水解,可知一水合氨更弱,其k更小,则Ka(HNO2)>Kb(NH3•H2O),故B错误;
C、①NH4+(aq)+$\frac{3}{2}$O2(g)=NO2-(aq)+2H+(aq)+H2O(l)△H=-273kL/mol ②NO2-(aq)+$\frac{1}{2}$O2(g)=NO3-(aq)△H=-73kL/mol,依据盖斯定律①+②得到NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346kJ/mol,故C正确;
D、在上述第一次转化过程中,氢离子浓度增大,废水的酸性增大,第二次转化过程中氢离子浓度不变,故D错误;
故选C.
点评 本题考查热化学方程式的分析计算,微粒电子数的计算应用,弱电解质电离平衡的分析判断,盐类水解应用,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
19.下列实验操作可以达到实验目的是( )(填序号,多填扣分)
| A. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| C. | 用饱和Na2CO3溶液除去乙酸乙酯中的少量乙酸 | |
| D. | 利用燃烧的方法鉴别羊毛和蚕丝 |
6.设NA为阿伏伽德罗常数的值,下列叙述一定正确的是( )
| A. | 1 L 2 mol•L-1的NH4Cl溶液中含有的NH4+数目为2NA | |
| B. | 标况下,0.1mol苯中含有C=C键数目为0.3NA | |
| C. | 常温常压下,5.2g乙炔和苯的混合气体中含有的碳原子数为0.4NA | |
| D. | 7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
3.下列行为符合实验安全要求的是( )
| A. | 实验室废液直接倒入水槽中 | |
| B. | 点燃可燃性气体前,必须检验气体的纯度 | |
| C. | 不慎洒出的酒精在实验台上着火时,立即用水浇灭 | |
| D. | 大量氯气泄漏时,迅速离开现场,并尽量向低凹处去 |







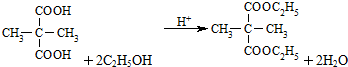 .
. 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有: