题目内容
有关如图装置,描述正确的是( )


| A、电流从锌电极经金属导线流向铜电极 |
| B、锌为阴极,铜为阳极 |
| C、负极的电极反应式为:Zn-2e→Zn2+ |
| D、一段时间后,溶液中阳离子总浓度增大、阴离子浓度不变 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.原电池中电流从正极经导线流向负极;
B.本装置为原电池,锌为负极、铜为正极;
C.负极发生氧化反应,Zn放电生成Zn2+;
D.电池总反应为:Zn+2H+=Zn2++H2↑,据此判断.
B.本装置为原电池,锌为负极、铜为正极;
C.负极发生氧化反应,Zn放电生成Zn2+;
D.电池总反应为:Zn+2H+=Zn2++H2↑,据此判断.
解答:
解:A.Zn为负极,Cu为正极,原电池中电流从Cu极经导线流向Zn极,故A错误;
B.本装置为原电池,本质是Zn与硫酸反应生成硫酸锌与氢气,锌为负极、铜为正极,故B错误;
C.负极发生氧化反应,Zn放电生成Zn2+,电极反应式为:Zn-2e→Zn2+,故C正确;
D.电池总反应为:Zn+2H+=Zn2++H2↑,消耗2mol氢离子生成1molZn2+,一段时间后,溶液中阳离子总浓度减小,由电荷守恒可知阴离子浓度不变,故D错误,
故选C.
B.本装置为原电池,本质是Zn与硫酸反应生成硫酸锌与氢气,锌为负极、铜为正极,故B错误;
C.负极发生氧化反应,Zn放电生成Zn2+,电极反应式为:Zn-2e→Zn2+,故C正确;
D.电池总反应为:Zn+2H+=Zn2++H2↑,消耗2mol氢离子生成1molZn2+,一段时间后,溶液中阳离子总浓度减小,由电荷守恒可知阴离子浓度不变,故D错误,
故选C.
点评:本题考查原电池工作原理,难度不大,侧重对基础知识的巩固,注意理解原电池的构成条件、电极反应.

练习册系列答案
相关题目
在组装原电池时,下列各项中不需要的是( )
| A、电极材料 | B、直流电源 |
| C、电解质溶液 | D、金属导线 |
化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是( )
| A、纯碱厂用侯氏制碱法制纯碱 |
| B、硝酸厂用氨氧化法制硝酸 |
| C、硫酸厂用接触法生产硫酸 |
| D、氮肥厂用氮气和氢气合成氨气 |
NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
| A、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移4NA个电子 |
| B、常温常压下,33.6L Cl2与56g Fe充分反应,转移电子数为3NA |
| C、标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、在1L 0.2mol?L-1的硫酸铁溶液中含有的铁离子数为0.4NA |
下列说法正确的是( )
①分子组成为C4H10O的醇有4种
②1mol CH≡CH与足量的HCl加成后再与Cl2发生取代反应,反应完全共需4mol Cl2
③(CH3)3CCH2CH3的一氯代物有3种
④石油裂解和油脂皂化都是由高分子生成小分子的过程.
①分子组成为C4H10O的醇有4种
②1mol CH≡CH与足量的HCl加成后再与Cl2发生取代反应,反应完全共需4mol Cl2
③(CH3)3CCH2CH3的一氯代物有3种
④石油裂解和油脂皂化都是由高分子生成小分子的过程.
| A、①②③④全正确 |
| B、只有①②③正确 |
| C、只有①③正确 |
| D、只有①③④正确 |
下列物质中,化学键类型和分子空间构型皆相同的是( )
| A、CO2和SO2 |
| B、CH4和SiH4 |
| C、BF3和PH3 |
| D、HCl和NH4Cl |
晶体具有各向异性.如蓝晶石(Al2O3?SiO2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000.晶体各向异性的主要表现是( )
①硬度 ②导热性 ③导电性 ④光学性质.
①硬度 ②导热性 ③导电性 ④光学性质.
| A、①③ | B、②④ |
| C、①②③ | D、①②③④ |
下列说法正确的是( )
A、金属的晶胞如图所示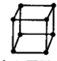 ,其配位数为8 ,其配位数为8 | ||||||||
| B、SO2分子中,S原子的价层电子对数为3,中心原子上孤电子对数为1,S原子为sp3杂化,是直线型分子 | ||||||||
| C、醋酸钠溶液中离子浓度的关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||||||||
D、已知反应2CH3OH(g)?CH3OCH3+H2O(g),某温度下的平衡常数为400,此温度下,在恒容密闭容器中加入一定量CH3OH,某时刻测得各组分浓度如下表,则此时正、逆反应速率的大小关系为:v正>v逆
|
已知H2S为弱酸,关于硫化氢水溶液,下列说法不正确的是( )
| A、常温下,pH小于7 |
| B、存在关系式:c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、25℃时,由水电离产生的c(H+)>1×10-7mol?L-1 |
| D、向溶液中加入少量NaOH固体,c(S2-)增大 |