题目内容
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
(1)此浓盐酸的物质的量浓度是 ?(列式计算)
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸 mL.(列式计算)
(3)还原4.8g金属氧化物,参加反应的氢气为2.016L(标准状况),生成的金属溶于上述盐酸,放出氢气1.344 L(标准状况),此金属氧化物是 。
A.Fe2O3 B.ZnO C.CuO
(4)将5.0 g CaCO3加入到足量的盐酸中,并将生成的气体全部通入足量的红热的碳中充分反应,可得到气体的体积为 。(折算成标况下)
(5)某金属R与一定体积的上述盐酸正好完全反应所得氯化物溶液20 mL,浓度为0.05 mol/L。它恰好能与20 mL 0.15 mol·L-1 的AgNO3溶液完全反应,则该氯化物的化学式 .
【答案】(1)12mol/L (2)25.0mL (3)A (4)2.24L (5)RCl3
【解析】
试题分析:(1)c=![]() =
=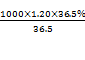 mol/L =12mol/L。
mol/L =12mol/L。
(2)溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀)计算,设需浓盐酸的体积为x,0.10L×3.00mol/L=12.0mol/Lx=0.025L,即25mL。
(3)该金属氧化物还原用的氢气量和它的单质与足量的盐酸反应放出的氢气的体积不同,所以该元素存在变价,2.016L/1.344L =1.5=3:2可知,金属与酸反应时是二价的,而在氧化物中金属元素的化合价是3价的,则金属氧化物的化学式就可以写成R2O3,故该题选A。
(4)5g碳酸钙的物质的量为5g/100g/mol=0.05mol,根据碳元素守恒可知,碳酸钙与盐酸反应生成二氧化碳为0.05mol,根据CO2+C![]() 2CO,可知生成CO为0.05mol×2=0.1mol,故标况下生成CO体积为0.1mol×22.4L/mol=2.24L。
2CO,可知生成CO为0.05mol×2=0.1mol,故标况下生成CO体积为0.1mol×22.4L/mol=2.24L。
(5)RCln的物质的量是20mL×0.05mol/L/1000mL/L=0.001mol,AgNO3的物质的量是20mL×0.15mol/L/1000mL/L=0.003mol,假设金属氯化物的化学式为RCln,则发生反应的方程式为:RCln+ nAgNO3![]() R(NO3)n + nAgCl↓,根据化学方程式计算可得:
R(NO3)n + nAgCl↓,根据化学方程式计算可得:
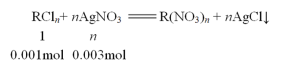
解得n=3,故金属氯化物的化学式为RCl3。

 全优点练单元计划系列答案
全优点练单元计划系列答案