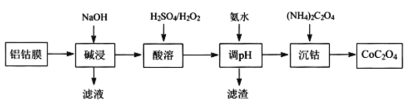
题目内容
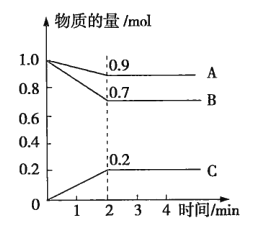
【题目】某温度时,在2L的密闭容器中,A、B、C三种气体的物质的量随时间的变化曲线如图所示。由图中数据分析
(1)该反应的反应物是_______。
(2)该反应_______(填“是”或“不是”)可逆反应,原因是______________。写出该反应的化学方程式:_______。
(3)反应开始至2min时,用C表示的平均反应速率为_______。
【答案】A、B 是 反应物不能完全反应,某一时刻A、B、C同时存在,且量不再变化 A(g)+3B(g)![]() 2C(g) 0.05mol/(Lmin)
2C(g) 0.05mol/(Lmin)
【解析】
(1)由图中数据可以看出,反应未进行时,A、B都具有最大物质的量,而C的物质的量为0,由此可确定反应物与生成物。
(2)当物质的量不再改变时,A、B、C的物质的量都不为0,则表明反应没有进行到底。
(3)从图中采集数据,可计算出C表示的平均反应速率。
(1)反应过程中A、B的物质的量减少,是反应物;C的物质的量增加,是生成物。答案为:A、B;
(2)该反应中,反应物不能完全反应,某一时刻A、B、C同时存在,且量不再变化,所以该反应是可逆反应。2min时反应达到平衡,A、B、C三种气体的物质的量的变化量依次为0.1mol、0.3mol、0.2mol,物质的量的变化量之比为l:3:2,因为物质的量的变化量之比等于化学计量数之比,所以该反应的化学方程式为A(g)+3B(g)![]() 2C(g)。答案为:是;反应物不能完全反应,某一时刻A、B、C同时存在,且量不再变化;A(g)+3B(g)
2C(g)。答案为:是;反应物不能完全反应,某一时刻A、B、C同时存在,且量不再变化;A(g)+3B(g)![]() 2C(g);
2C(g);
(3)从反应开始至2min时,C的物质的量从0增加到0.2mol,用C表示的平均反应速率为![]() =0.05mol/(Lmin)。答案为:05mol/(Lmin)。
=0.05mol/(Lmin)。答案为:05mol/(Lmin)。

 英才计划期末调研系列答案
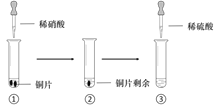
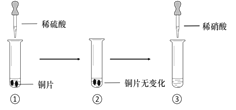
英才计划期末调研系列答案【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O