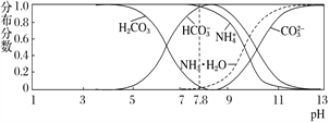
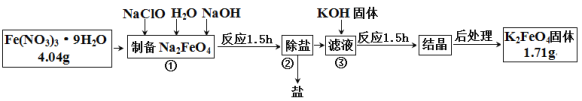
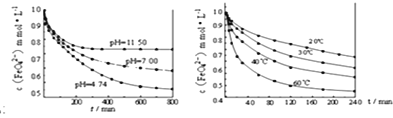
题目内容
【题目】少量的金属钠长期暴露在空气中,它的最终产物是( )
A.Na2O2B.NaHCO3C.Na2CO3D.Na2CO3·10H2O
【答案】C
【解析】
切开金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO310H2O)→最后变成Na2CO3粉末(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,故答案为C。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做制冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
2H2(g)+CO(g)![]() CH3OH(g)△H=-90.0kJ·mol-1①
CH3OH(g)△H=-90.0kJ·mol-1①
2CH3OH(g)![]() CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.1kJ·mol-1③
CO2(g)+H2(g)△H=-41.1kJ·mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO![]() CH3OCH3+CO2的热化学方程式为____________________。
CH3OCH3+CO2的热化学方程式为____________________。
(2)已知一些共价键的键能如下:
化学键 | H-H | C-H | C-O | O-H |
键能(kJ·mol-1) | 436 | 414 | 326 | 464 |
运用反应①计算一氧化碳中碳氧共价键的键能____________kJmol-1。
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=____________。