题目内容
下列离子方程式书写正确的是
| A.铝粉投入到NaOH溶液中:2Al+2OH-= 2AlO2-+H2↑ |
| B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓ |
C.三氯化铁溶液中加入铁粉: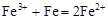 |
| D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
D
解析试题分析:A.2Al+2OH-+2H2O=2AlO2-+3H2↑;错误。B.氨水是弱碱,在溶液中主要以离子的形式存在。且Al(OH)3只能被强酸、强碱溶解。因此离子方程式为:Al3++3NH3·H2O=3 NH4++Al(OH)3↓.错误;C.三氯化铁溶液中加入铁粉,没配平,电荷、电子不守恒;正确的应该是:2Fe3++Fe=3Fe2+.D,反应符合客观事实,拆写符合离子方程式的原则。正确。
考点:考查离子方程式正误判断的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol/L KMnO4溶液:K+、Na+、I-、Cl- |
| B.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- |
| C.加入KSCN显红色的溶液:K+、Mg2+、Cl-、SO42- |
| D.水电离出c(OH-)=10-5mol/L的溶液:Na+、Fe2+、Cl-、NO3- |
下列反应的离子方程式正确的是( )
| A.钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C.碳酸氢钠溶液中加入氢氧化钠:HCO3- +OH—= CO2↑+H2O |
| D.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- |
| B.10 mol·L-1的浓氨水:Al3+、NH4+、NO3-、I— |
| C.0.1 mol·L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl— |
| D.c(H+)/c(OH—)=1×10—12的溶液:K+、Na+、AlO2—、CO32— |
下列各组粒子在指定溶液中能大量共存的是
A.pH=l的溶液中: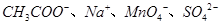 |
B.加入A1能放出H2的溶液中: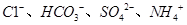 |
C.含有大量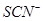 的溶液中: 的溶液中: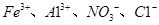 |
D.由水电离出的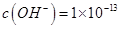 mol mol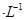 的溶液中: 的溶液中: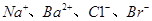 |
某溶液中含有NO、 、
、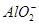 、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
| A.只有S2- | B.S2-和NO3- |
C. 、S2-和NO3- 、S2-和NO3- | D.4种离子都减少 |
下列离子方程式表示正确的是( )。
| A.往FeI2溶液中通入过量氯气:Cl2+2Fe2+=2Cl-+2Fe3+ |
| B.将明矾溶于水中生成胶体:Al3++3H2O??Al(OH)3(胶体)+3H+ |
| C.大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2一、CO32-、S2一、SO32-、SO42-
现取该溶液进行有关实验,实验过程及现象如下: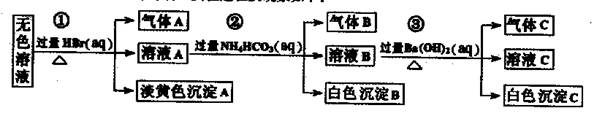
下列说法正确的是
| A.根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr |
| B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ |
| C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 |
| D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- |
| B.c(H+)/c(OH-)=10-10的溶液:K+、Ba2+、NO3-、Cl- |
| C.pH=0的溶液:Al3+、Ag(NH3) 2-、Cl-、SO42- |
| D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |