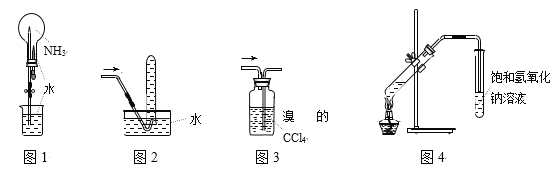
题目内容
【题目】下列反应中,浓硫酸既表现强酸性,又表现强氧化性的是
A. 硫和浓硫酸共热B. 铜和浓硫酸共热
C. 食盐和浓硫酸共热D. 蔗糖中滴入浓硫酸
【答案】B
【解析】
在反应中浓硫酸体现酸性,说明和物质反应生成硫酸盐,又体现强氧化性,说明在反应中S元素得电子化合价降低,据此分析解答。
A.发生的反应为S+2H2SO4(浓)![]() 3SO2↑+2H2O,该反应硫酸中S元素化合价由+6价变为+4价,所以浓硫酸作氧化剂,体现氧化性,A项错误;
3SO2↑+2H2O,该反应硫酸中S元素化合价由+6价变为+4价,所以浓硫酸作氧化剂,体现氧化性,A项错误;
B.发生的反应为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,该反应中部分S元素化合价不变、部分S元素化合价由+6价变为+4价,所以浓硫酸体现强酸性、强氧化性,B项正确;
CuSO4+SO2↑+2H2O,该反应中部分S元素化合价不变、部分S元素化合价由+6价变为+4价,所以浓硫酸体现强酸性、强氧化性,B项正确;
C.发生的反应为2NaCl+H2SO4(浓)![]() 2HCl↑+Na2SO4,该反应中各元素化合价不变,属于复分解反应,浓硫酸体现酸性,C项错误;
2HCl↑+Na2SO4,该反应中各元素化合价不变,属于复分解反应,浓硫酸体现酸性,C项错误;
D.浓硫酸将有机物中的H、O元素以2:1水的形式脱去而体现脱水性,还能将C氧化为二氧化碳而体现强氧化性,D项错误;
答案选B。

【题目】下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)元素⑤⑥⑦的简单离子半径大小顺序__________;②在元素周期表位置________;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________。
(4)④、⑧、⑩的氢化物沸点最高的是__________,原因是__________。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________。