题目内容
【题目】通过测定混合气中![]() 含量可计算已变质的
含量可计算已变质的![]() 含
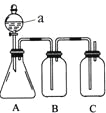
含![]() 纯度,实验装置如图
纯度,实验装置如图![]() 为弹性良好的气囊
为弹性良好的气囊![]() ,下列分析错误的是
,下列分析错误的是![]()
![]()

A.干燥管b中装入碱石灰
B.测定气体总体积必须关闭![]() 、
、![]() ,打开
,打开![]()
C.测定总体积后,关闭![]() ,打开
,打开![]() ,可观察到Q气球慢慢缩小,并测出氧气体积
,可观察到Q气球慢慢缩小,并测出氧气体积
D.Q气球中产生的气体主要成份![]() 、
、![]()
【答案】C
【解析】
本题考查混合物含量的测定,题目难度中等,本题要搞清量筒Ⅰ、Ⅱ的作用,根据反应的化学方程式计算即可解答。
A.加入稀硫酸与样品反应,在Q气球中得到二氧化碳和氧气,用碱石灰吸收二氧化碳和水蒸气,在量筒Ⅱ中排水法测氧气的量,进而计算过氧化钠的量,故A正确;
B.反应产生的![]() 、
、![]() 使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的
使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的![]() 、
、![]() 的总体积,所以滴稀
的总体积,所以滴稀![]() 前必须关闭
前必须关闭![]() 、
、![]() 打开
打开![]() ,故B正确;
,故B正确;
C.读取气体总体积后关闭![]() 缓缓打开
缓缓打开![]() 还要打开
还要打开![]() ,才能观察到Q气球慢慢缩小,原因是不打开
,才能观察到Q气球慢慢缩小,原因是不打开![]() 体系是密闭的,气球体积无法减小,故C错误;
体系是密闭的,气球体积无法减小,故C错误;
D.加入酸后Q内发生反应:![]() ;
;![]() ,反应产生
,反应产生![]() 、
、![]() 气体,故D正确。
气体,故D正确。
故选C。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
【题目】已知SiO2+2C![]() Si+2CO↑;Si+C
Si+2CO↑;Si+C![]() SiC。
SiC。
现有石英砂和炭粉的混合物1mol,于高温下在电炉里充分反应后,得残留固体;若石英砂与混和物的物质的量之比n(0<n<1),试讨论n取何值时,残留物的成分及其物质的量。
n | 例︰n= | __ | __ | __ | __ |
残留固体及物质的量(摩) | Si | __ | __ | __ | __ |
___________。