题目内容
【题目】在生产和生活中,金属材料几乎无处不在.
(1)金属的用途和性质紧密相关.已知金属的物理性质有①导热性、②导电性、③还原性、④延展性.请在下面金属用途后填上金属性质对应的序号.
金属的用途 | 对应的金属物理性质 |
用铝定制成包装用的铝箔 | |
用铁、铝等做炊具 | |
用铜与氯化铁溶液反应制作印刷电路 | |
电信业中大量使用的铜丝、金属电缆 |
(2)铝是一种活泼金属,具有较强的还原性.
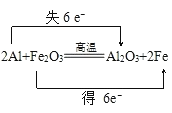
①金属铝在高温下与三氧化二铁反应,2Al+Fe2O3![]() Al2O3+2Fe,称为铝热反应.试用双线桥法表示电子转移情况 :2Al+Fe2O3
Al2O3+2Fe,称为铝热反应.试用双线桥法表示电子转移情况 :2Al+Fe2O3![]() Al2O3+2Fe,该反应中 是氧化剂(填写化学式), 是还原剂(填写化学式)。反应中生成1mol Fe时,转移 mol电子。
Al2O3+2Fe,该反应中 是氧化剂(填写化学式), 是还原剂(填写化学式)。反应中生成1mol Fe时,转移 mol电子。
②常温时,能用铝制容器盛装的试剂有 (填序号)
A.浓硫酸 B.稀硫酸 C.浓硝酸 D.稀硝酸
③能否用铝制容器盛装NaOH溶液? (填“能”或“不能”),用化学方程式解释: 。
(3)钠是种重要的金属.请回答:将一小块金属钠投入水中,发生反应的化学方程式为 ;可观察到的实验现象是 (填字母)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动。
【答案】
(1)④;①;③;②
(2) ;Fe2O3;Al;3;AC;不能;2Al+2NaOH+2H2O═2NaAlO2+3H2↑
;Fe2O3;Al;3;AC;不能;2Al+2NaOH+2H2O═2NaAlO2+3H2↑
(3)2Na+2H2O═2NaOH+H2↑;bc
【解析】(1)用铝箔做包装品材料利用了铝的延展性;用、铁铝制成的高压铝锅等炊具利用了铝的导热性;用铜与氯化铁溶液反应制作印刷电路利用了Cu的还原性,用铜丝、金属作电缆利用了金属的导电性,所以答案是:④①③②;
(2)①反应2Al+Fe2O3![]() Al2O3+2Fe中,化合价降低元素Fe所在的反应物Fe2O3是氧化剂,化合价升高元素Al所在的反应物是还原剂,化合价的升降数=转移电子数=6,所以反应中生成1mol Fe时,转移6mol电子,电子转移情况如下:
Al2O3+2Fe中,化合价降低元素Fe所在的反应物Fe2O3是氧化剂,化合价升高元素Al所在的反应物是还原剂,化合价的升降数=转移电子数=6,所以反应中生成1mol Fe时,转移6mol电子,电子转移情况如下: ,
,
所以答案是: ;Fe2O3;Al;3;
;Fe2O3;Al;3;
②金属铝在常温下遇到浓硫酸、浓硝酸会发生钝化,能用铝制容器盛装,所以答案是:AC;
③金属铝能和强碱氢氧化钠反应生成盐和氢气,即2Al+2NaOH+2H2O═2NaAlO2+3H2↑,所以不能用铝制容器盛放氢氧化钠,所以答案是:不能;2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)金属钠可以和水反应生成氢氧化钠和氢气,即2Na+2H2O═2NaOH+H2↑,金属钠的熔点较低,所以钠熔成小球,因为产生了氢气,所以小球四处游动,金属钠的密度小于水,应该浮在液面上,所以答案是:bc.

 名校课堂系列答案
名校课堂系列答案